
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
(1)W2-离子的结构示意图为______________,E元素在周期表中的位置为____________,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式____________________。
(2)经测定A2W2为二元弱酸,A2W2的电子式为___________,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式__________________________。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,该反应的离子方程式是_____________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式______________________,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________L(标准状况下)。
【答案】 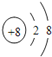 第三周期第ⅢA族 Al2O3+2OH﹣=2AlO2﹣+H2O
第三周期第ⅢA族 Al2O3+2OH﹣=2AlO2﹣+H2O ![]() BaO2+H2SO4=BaSO4↓+H2O2 2Fe2++4I﹣+3H2O2=2Fe(OH)3↓+2I2 NaH+H2O=NaOH+H2↑ 56
BaO2+H2SO4=BaSO4↓+H2O2 2Fe2++4I﹣+3H2O2=2Fe(OH)3↓+2I2 NaH+H2O=NaOH+H2↑ 56
【解析】试题分析:A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,D的原子序数大于B,且为短周期元素,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,ⅢA族元素,故E为Al元素;A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,设B的原子序数为x,则有:1+x+8+11+13=39,x=6,所以B为C元素,根据分析可知:A为H、B为C、W为O、D为Na、E为Al。
解析:(1)O2-离子的结构示意图为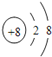 ,Al元素在周期表中的位置为第三周期第ⅢA族, E的最高价氧化物是氢氧化铝、D的最高价氧化物的水化物是氢氧化钠,氢氧化铝与氢氧化钠反应生成偏铝酸钠的离子方程式Al2O3+2OH﹣=2AlO2﹣+H2O。
,Al元素在周期表中的位置为第三周期第ⅢA族, E的最高价氧化物是氢氧化铝、D的最高价氧化物的水化物是氢氧化钠,氢氧化铝与氢氧化钠反应生成偏铝酸钠的离子方程式Al2O3+2OH﹣=2AlO2﹣+H2O。
(2)H2O2是共价化合物,电子式为![]() ,硫酸与BaO2反应生成H2O2和硫酸钡的化学方程式BaO2+H2SO4=BaSO4↓+H2O2。
,硫酸与BaO2反应生成H2O2和硫酸钡的化学方程式BaO2+H2SO4=BaSO4↓+H2O2。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入H2O2,观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,说明有2mol 碘离子和1mol Fe2+,该反应的离子方程式是2Fe2++4I﹣+3H2O2=2Fe(OH)3↓+2I2。
(4)钠在一定条件下,能与氢气化合生成NaH,NaH与水反应生成氢氧化钠和氢气,该反应方程式NaH+H2O=NaOH+H2↑,若将1mol NaH与水反应生成1mol氢氧化钠和1mol氢气,1mol氢氧化钠与1mol铝混合,发生反应2Al+2OH-+2H2O=2AlO2-+3H2放出氢气1.5mol,反应后共生成氢气2.5mol,体积是56L(标准状况下)。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】关于合金的叙述:①合金中至少含两种金属;②合金中的元素以化合物的形式存在;③合金中一定含金属;④合金一定是混合物。其中正确的是
A. ①②③④ B. ①③④ C. ②③④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述中正确的是
A.所有的金属都是固态的
B.金属具有导电性、导热性和延展性
C.活泼的金属、或较活泼的金属能与酸反应,但不能与碱反应
D.金属元素在自然界中都是以化合态存在的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):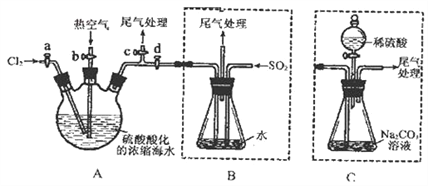
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2;
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)步骤②中鼓入热空气的作用为_____________________________;
(2)步骤③中发生的主要反应的离子方程式为______________________________。
(3)此实验中尾气可用______(填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCI溶液
(4)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为____________。
(5)与B装置相比,采用C装置的优点为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Mg、Al、Fe 、Cu是中学阶段常见的几种重要金属元素,请回答以下问题:
(1)Fe在周期表中第____周期,第____族;它的核外电子排布式:_________;
(2)Al的价电子轨道表示式:____________;与其同族中第四周期的元素名称,元素符号____。
(3)Mg的原子结构示意图:____________; Na、Mg、Al第一电离能的由大到小顺序:___________(用元素符号表示)
(4)Cu2+的未成对电子数:____,在硫酸铜溶液中通入氨气直至过量发生的化学反应_____________________________________________(写离子方程式),小心蒸发,最终得到的[Cu(NH3)4]SO4晶体中含有的化学键除了普通共价键外,还有________和________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去)请回答下列问题:
I. Cl2的制备。
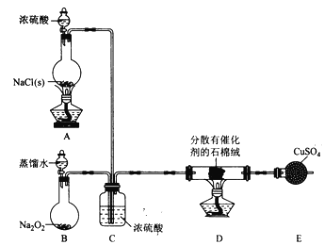
(1)装置B中发生反应的化学方程式为____________________。
(2)装置C的作用除干燥气体外还有_________________。
(3)装置 E中盛放CuSO4的仪器名称为_______________;反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为_____________________。
II. Cl2性质的验证。
该小组用实验I中制得的Cl2和如图所示装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S
査阅资料:
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物;
②少量CO2不干扰实验;
③该实验条件下,C与Cl2不反应。
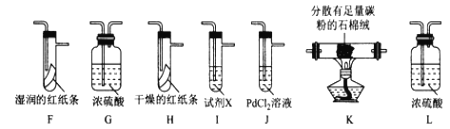
(4)按气流从左到右的方向,装置连接的合理顺序为E→__→__→__→__→__→__→__→尾气处理____________(填装置字母,)
(5)试剂X的名称为____________。
(6)装置J中发生反应的化学方程式为_________________。
(7)设计实验证明经净化后的Cl2中不含HC1:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出甲醇(CH3OH)和空气组成的燃料电池当电解质溶液为KOH时,其正电极反应式为__________,负极反应式为__________。
(2)NaCl熔化时被破坏的是_____________;酒精溶于水时破坏的是___________;(填“离子键”“极性键”“非极性键”或“分子间作用力”):
(3)写出下列物质的电子式:
CO2_______________ Na3N _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. pH=a的氨水溶液,稀释10倍后,其pH=b,则b<a-1
B. pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<①
C. 某温度Ksp(Ag2S)=6×10-50, Ksp(AgCl)=2×10-6, 则 2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×1037
Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×1037
D. 一定浓度的 NaHS 溶液中:c(Na+)+c(OH-)==c(H+)+c(HS-)+2c(H2S)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com