
【题目】周期表里的四种短周期主族元素的相对位置如下所示。已知它们的原子序数总和为38,用元素符号回答以下问题:
m | n | x | |
y |
(1)元素n的原子序数为________;
(2) m、n、x第一电离能的由小到大的顺序:电负性的由大到小的顺序:________。(用元素符号表示)
(3)m、x按照1:2所形成化合物的电子式: ________,分子构型:_____;
(4)用以上任意两种元素写出一个含有极性键的5原子非极性分子式:___
【答案】 7 C<O<N O>N>C ![]() 直线型 CCl4
直线型 CCl4
【解析】根据周期表里的四种短周期主族元素的相对位置,设m的原子序数为a,则n为a+1,x为a+2,y为a+3+8。它们的原子序数总和为38,即a+(a+1)+(a+2)+(a+3+8)=38,解得a=6,则m为C元素,n为N元素,x为O元素,y为Cl元素。
(1)根据上述分析,元素n为N元素,原子序数为7,故答案为:7;
(2) 同一周期,从左到右,第一电离能逐渐增大,N元素的2p为半充满状态,较为稳定,第一电离能大于O,C、N、O第一电离能的由小到大的顺序为C<O<N;
元素的非金属性越强,电负性越大,电负性的由大到小的顺序为O>N>C,故答案为:C<O<N;O>N>C;
(3) m、x按照1:2所形成化合物为二氧化碳,电子式为![]() ,C原子为sp杂化,分子构型为直线形,故答案为:
,C原子为sp杂化,分子构型为直线形,故答案为:![]() ;直线型;
;直线型;
(4)以上任意两种元素形成的含有极性键的5原子非极性分子为CCl4,故答案为:CCl4。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】科学家曾合成了一系列具有独特化学特性的(A1H3)n氢铝化合物。己知,最简单的氢铝化合物的分子式为A12H6,它的熔点为150 ℃,燃烧热极高。A12H6球棍模型如图。下列有关说法肯定错误的是

A. Al2H6在固态时所形成的晶体是分子晶体
B. 氢铝化合物可能成为未来的储氢材料和火箭燃料
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. Al2H6中含有极性共价键、配位键和离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):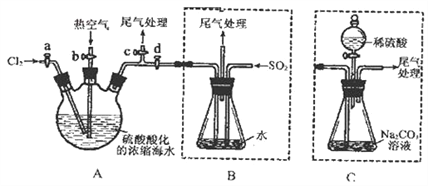
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2;
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)步骤②中鼓入热空气的作用为_____________________________;
(2)步骤③中发生的主要反应的离子方程式为______________________________。
(3)此实验中尾气可用______(填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCI溶液
(4)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为____________。
(5)与B装置相比,采用C装置的优点为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.稀硫酸和铜粉反应可制备硫酸铜
B.碘化钾与浓硫酸反应可制备碘化氢
C.过氧化钠与二氧化碳反应可制备氧气
D.铝箔在氯气中燃烧可制备无水三氯化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去)请回答下列问题:
I. Cl2的制备。
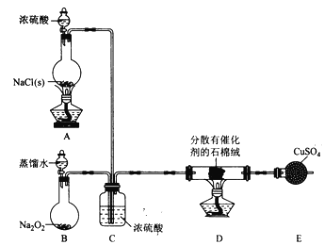
(1)装置B中发生反应的化学方程式为____________________。
(2)装置C的作用除干燥气体外还有_________________。
(3)装置 E中盛放CuSO4的仪器名称为_______________;反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为_____________________。
II. Cl2性质的验证。
该小组用实验I中制得的Cl2和如图所示装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S
査阅资料:
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物;
②少量CO2不干扰实验;
③该实验条件下,C与Cl2不反应。
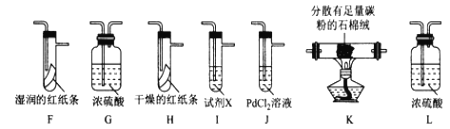
(4)按气流从左到右的方向,装置连接的合理顺序为E→__→__→__→__→__→__→__→尾气处理____________(填装置字母,)
(5)试剂X的名称为____________。
(6)装置J中发生反应的化学方程式为_________________。
(7)设计实验证明经净化后的Cl2中不含HC1:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.8 mol·L-1·s-1
B. 在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
C. 分别用B、C、D表示反应的速率,其比值是3∶2∶1
D. 在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东北虎主要分布在我国长白山、小兴安岭等地,华南虎主要分布在我国长江流域以南地区,根据我们学过的知识判断,东北虎之所以适应了其生存环境,与华南虎相比,下列哪种物质含量所占比例明显高( )
A. 脂肪 B. 糖原 C. 蛋白质 D. 核酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2为V形的极性分子 B. ClO3﹣的空间构型为平面三角形
C. SiF4和SO32﹣的中心原子均为sp2杂化 D. SF6中有6对相同的成键电子对
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com