
NA表示阿伏加德罗常数的数值,下列说法正确的是
A.用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2 NA时,阴极析出4 g金属
B.0.1 mol24Mg32S晶体中所含中子总数为2.8 NA
C.常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4 L
D.在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2 NA
科目:高中化学 来源: 题型:
在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
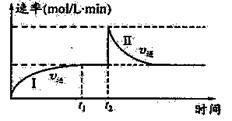
A. 0~t2时,v(正)>v(逆)
B. t2时刻改变的条件可能是加催化剂
C.Ⅰ、Ⅱ两过程达到反应限度时,A的体积分数Ⅰ=Ⅱ
D.Ⅰ、Ⅱ两过程达到反应限度时,平衡常数I<Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法合理的是 ( )
A.在稀硫酸中加入铜粉,铜粉不溶解;再加入K NO3 固体,铜粉仍不溶解
B.将等物质的量Cl2与SO2通入品红溶液,漂白性增强
C.浓H2SO4与Cu或C反应都需加热,浓硝酸与Cu或C反应都不需加热
D.铝、氧化铝、小苏打、醋酸铵都既能与盐酸又能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-。将该混合物溶于水后得澄清溶液.现取3份l00mL该溶液分别进行如下实验:
| 试验序号 | 试验内容 | 试验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体 1.12L(已折算成标准状况下的体积)[][] |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为 6.27g,第二次称量读数为 2.33g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验l~3判断混合物中一定不存在的离子是 。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度(mo1·L-) |
(3)试确定K+是否存在? ,判断的理由
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,
则a b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是: (填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式 。

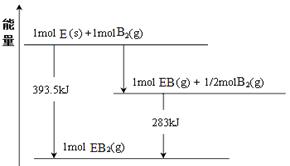
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨所需的氢气可由水煤气反应制得,其中的一步反应为:CO(g)+H2O(g)⇌CO2(g)+H2(g);△H=﹣43kJ•mol﹣1对于上述反应,下列措施中能提高CO转化率的是( )
|
| A. | 增大压强 | B. | 升高温度 |
|
| C. | 增大水蒸气的浓度 | D. | 增大CO的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,在定压容器a与定容容器b中,分别通入等量且体积比为1:3的N2和H2,开始时体积相同,达到平衡时,N2的转化率是( )
|
| A. | a大 | B. | b大 | C. | a、b一样大 | D. | 不一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,电解质溶液为KOH,放电时的总反应式为:( )
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是
A.放电时负极反应为:3Zn —6e—+6OH— == 3Zn(OH)2
B.放电时OH—向正极移动
C.充电时每转移3 mol电子,阳极有1 mol Fe(OH)3 被还原
D.充电时阳极反应式为:3Zn(OH)2+6e— == 3Zn+6OH—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com