
 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,
则a b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是: (填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
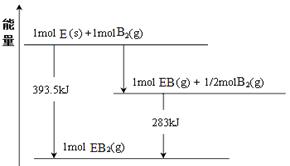
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式 。

(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为 。
【知识点】元素周期表、元素及其化合物知识、电离、热化学方程式、原电池原理
【答案解析】(1)NH3·H2O NH4+ + OH-(2分) (2)>(2分)(3)Al(OH)3(2分)(4) ①③(2分)(5)Na3N + 4H2O=3NaOH + NH3·H2O(2分)
NH4+ + OH-(2分) (2)>(2分)(3)Al(OH)3(2分)(4) ①③(2分)(5)Na3N + 4H2O=3NaOH + NH3·H2O(2分)
(6)CO2(g) + C(s) = 2CO(g) ; △H= +172.5kJ/mol
或1/2CO2(g) + 1/2 C(s) = CO(g) ; △H= +86.25kJ/mol (3分)
(7) Fe3++e-→Fe2+(2分)
解析:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物,A是氮元素;C单质一般保存在煤油中,这是钠元素;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,这是铝元素,G单质是日常生活中用量最大的金属,易被腐蚀或损坏,这是铁元素,根据表格B是氧元素;E是碳元素;D是氯元素。
A元素的氢化物是NH3,其水溶液氨水是弱碱,能电离出氢氧根,使酚酞变红:
NH3·H2O NH4+ + OH-
NH4+ + OH-
(2)同温同压下,将a L NH3气体和b L HCl气体通入水中,生成氯化铵,强酸弱碱盐,溶液呈酸性,若所得溶液的pH=7,氨气要过量;则a>b;
(3)常温下,相同浓度(设浓度均为C)Al、Fe简单离子的溶液中滴加NaOH溶液,Al(OH)3完全沉淀的pH是4.7,其Ksp=C.C3(OH-)=(10-9.3)3.C=10-27.9.C;Fe(OH)3完全沉淀的pH是2.8,其Ksp=C.C3(OH-)=(10-11.2)3.C=10-33.6.C则ksp较大的是Al(OH)3;
(4)A与B组成质量比为7:16的三原子分子是NO2,易溶于水,释放在空气中可能引发酸雨和光化学烟雾;而温室效应是因为二氧化碳的排放,臭氧层破坏是氟利昂等造成的。故选①③;
(5)N和Na组成的离子化合物是Na3N,能与水反应生成两种碱,该反应的化学方程式是Na3N + 4H2O=3NaOH + NH3·H2O
(6)根据能量图,①C(s)+O2(g)=CO2(g) △H1=-393.5KJ/mol
②CO(g)+1/2 O2(g)=CO2(g) △H2=-283.0KJ/mol;
由①-2②得:CO2(g) + C(s) = 2CO(g) △H= +172.5kJ/mol
(7)在Cl与Fe组成的化合物溶液中,加入铜片,溶液会慢慢变为蓝色,则甲是FeCl3溶液,原电池中石墨作正极,溶液中的铁离子得电子,发生还原反应,其电极反应式:
Fe3++e-→Fe2+
【思路点拨】本题主要是在元素推断的基础上考查弱电解质的电离、热化学方程式、原电池原理,综合性比较强;元素化合物知识如常见的钠镁铝铁等平时要多积累,题目难度不大。


科目:高中化学 来源: 题型:
在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应:2A(g)+B(g) 2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是
2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是
A.若反应开始时容器体积为2L,则v(C)=0.4mol?L-1?min-1
B.若该反应在恒温恒容下进行,放出热量将增加
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若在恒压绝热条件下反应,平衡后n(C)<1.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体。X、Y、Z是化合物。X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红。它们之间有如下图所示转化关系。请回答:
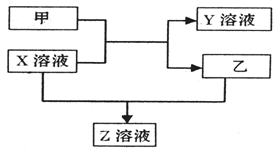
(1)将Y的饱和溶液滴入沸水中,加热至得到红褐色液体,关于此液体说法不正确的是
A. 该液体中加入稀硫酸的现象是先生成沉淀后溶解
B. 该液体的分散质不能透过半透膜
C. 此液体与Y溶液的本质区别是该液体能发生丁达尔现象
D. 将该液体加热蒸干、灼烧后,有氧化物生成
(2)①单质甲、乙和Y溶液中的阳离子氧化性由强到弱的顺序为:
(用化学式表示)
②少量单质甲通入X溶液中发生的离子方程式为
(3)实验室制备、收集纯净干燥的甲单质,所需仪器如下,装置A为发生装置;除装置A中所需的药品外,其他装置中供选择的药品有:浓硫酸、碱石灰、无水氯化钙、饱和食盐水、氢氧化钠溶液。
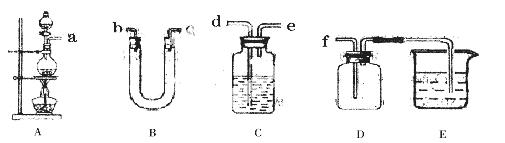
①装置A中发生反应的化学反应方程式:
②指出装置B、C中的药品(从提供的药品中选择):
B: C:
③装置D的作用是
装置E中发生反应的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的数值,下列说法正确的是
A.用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2 NA时,阴极析出4 g金属
B.0.1 mol24Mg32S晶体中所含中子总数为2.8 NA
C.常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4 L
D.在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中物质分类正确的是( )
| 编号 | A | B | C | D |
| 强电解质 | H2SO4 | KNO3 | BaSO4 | HClO4 |
| 弱电解质 | CaCO3 | HF | HClO | 氨水 |
| 非电解质 | NH3 | SO2 | H2O | C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于判断过程的方向的说法错误的是( )
|
| A. | NH4NO3溶于水吸热,说明其溶于水不是自发过程 |
|
| B. | 同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 |
|
| C. | 不借助于外力能自发进行的过程,其体系的能量趋向于从高能状态转变为低能状态 |
|
| D. | 由焓判据和熵判据组合而成的复合判据,更适合于所有的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
T℃,向5L恒容密闭容器中充入1molSO3气体,发生反应2SO3(g)⇌2SO2(g)+O2(g)
△H=+196kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量.当温度度不变时,改变某一条件,下列结论正确的是( )
| 条件改变 | 结论 | |
| A | 平衡后向容器中冲入1molHe | 平衡常数不变,混合气体的密度也不变 |
| B | 起始时向容器中冲入0.5molSO2、0.25molO2和2molSO3 | 反应达到平衡前v(正)>v(逆) |
| C | 起始时向容器中充入1molSO2和0.5mol O2 | 达到平衡时共放出78.4kJ的热量 |
| D | 起始时向容器中充入1molSO2和0.5molO2 | 达到平衡时,SO2的转化率为60% |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
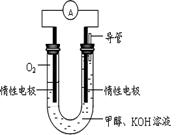 (1)该电池中OH-向_______极移动(填“正”或“负”)
(1)该电池中OH-向_______极移动(填“正”或“负”)
(2)该电池负极的电极反应为_______________________________。
(3)用该电池电解(惰性电极)500 mL某CuSO4溶液,电解一段时间后,
为使电解质溶液恢复到原状态,需要向溶液中加入9.8 g Cu(OH)2
固体。则原CuSO4溶液的物质的量浓度为_______________,
电解过程中收集到标准状况下的气体体积为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com