
在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应:2A(g)+B(g)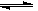 2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是
2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是
A.若反应开始时容器体积为2L,则v(C)=0.4mol?L-1?min-1
B.若该反应在恒温恒容下进行,放出热量将增加
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若在恒压绝热条件下反应,平衡后n(C)<1.6mol
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
在冶金工业上,通常均不能用化学还原剂制得的金属组是( )
A.Na、Ba、Mg、A1 B.Zn、Fe、Cu、Ag
C.Na、K、Zn、Fe D.Mg、Al、Zn、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
大气污染问题已成影响环境的重要因素,有人想利用下列反应:
2CO(g)+SO2(g) 2CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
2CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
查看答案和解析>>
科目:高中化学 来源: 题型:
在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
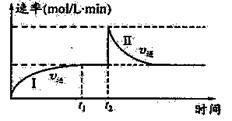
A. 0~t2时,v(正)>v(逆)
B. t2时刻改变的条件可能是加催化剂
C.Ⅰ、Ⅱ两过程达到反应限度时,A的体积分数Ⅰ=Ⅱ
D.Ⅰ、Ⅱ两过程达到反应限度时,平衡常数I<Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
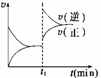
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
A.2SO2(g)+O2(g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
B.4 NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
C.H2(g)+I2(g)  2HI(g) ΔH>0
2HI(g) ΔH>0
D.2 NH3(g) N2(g) +3H2(g) ΔH>0
N2(g) +3H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为: 。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) 
 CH3OH(g) ΔH=-90.8kJ·mol-1
CH3OH(g) ΔH=-90.8kJ·mol-1
②2CH3OH(g) 
 CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
③CO(g)+H2O(g) 
 CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式 。
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 。
a.高温高压 b.低温低压 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚 f.加入催化剂
(4)已知反应②2CH3OH(g) 
 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”、“<”或“=”),若上述情况达到平衡,此时c(CH3OH)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
V L Fe2(SO4)3溶液中含Fe3+ m g,溶液中SO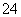 的物质的量浓度是(不考虑Fe3+水解)( )
的物质的量浓度是(不考虑Fe3+水解)( )
A .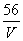 mol/L B .
mol/L B .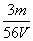 mol/L
mol/L
C . mol/L D.
mol/L D.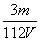 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,
则a b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是: (填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式 。

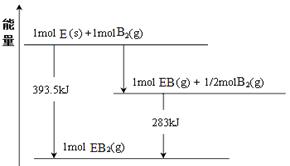
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com