
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3 , 进而生产出纯碱.有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).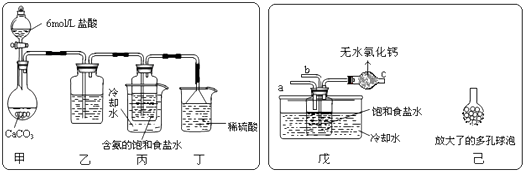
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是;
(Ⅱ)丁装置中稀硫酸的作用是;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是(填分离操作的名称).
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从管通入气体,再从管中通入气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: .
【答案】
(1)C
(2)饱和碳酸氢钠溶液;吸收未反应的NH3;过滤;a;NH3;b;CO2;增大气体与溶液接触面积,提高CO2吸收率
(3)用碳酸氢铵与适量饱和食盐水反应或往烧碱溶液中通入过量CO2;或往饱和Na2CO3溶液中通入过量CO2等
【解析】解:(1)a.碳酸氢钠易溶于水,故A错误;b.碳酸氢钠受热易分解,与其在溶液中首先结晶析出无关,故B错误;c.碳酸氢钠的溶解度相对于氯化铵来说碳酸氢钠的溶解度更小一些,所以在溶液中首先结晶析出,故C正确;故选C;(2)①(I)利用盐酸制取二氧化碳时,因盐酸易挥发,所以,二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,所以答案是:饱和碳酸氢钠溶液;(II)实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3 , 所以答案是:吸收未反应的NH3;(III)分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作,所以答案是:过滤;②(I)制取碳酸氢钠时先要得到含氨的饱和食盐水,氨气极易溶于水,二氧化碳能溶于水,所以应先通入氨气,所以a端通入,从而保证了从b通入二氧化碳时,二氧化碳被充分反应;所以答案是:a、NH3 , b、CO2;(II)装置改动后反应物的二氧化碳与溶液的接触面积变大,提高了二氧化碳的吸收率,所以答案是:增大气体与溶液接触面积,提高CO2吸收率;(3)从题干信息NH4HCO3+NaCl═NaHCO3↓+NH4Cl;可得制取碳酸氢钠的方法,同时也可采用烧碱溶液中通入过量CO2或往饱和Na2CO3 溶液中通入过量CO2 等得到碳酸氢钠,所以答案是:用碳酸氢铵与适量饱和食盐水反应,或往烧碱溶液中通入过量CO2;或往饱和Na2CO3 溶液中通入过量CO2 等.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 纯碱、烧碱均属于碱
B. CuSO4·5H2O属于纯净物
C. 凡能电离出H+的化合物均属于酸
D. 盐类物质一定含有金属阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeS04,较多的Cu2+和少量Na+。该工厂计划从废水中回收FeS04和金属铜。根据下列流程图,同答问题。
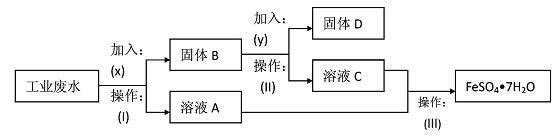
(1)加入的试剂x为____,y为____;
(2)加入试剂y发生反应的离子方程式是_______;
(3)操作(I)为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“足球烯”C60是一种外形类似足球状的分子,关于C60的说法错误的是( )
A.C60是一种新型的化合物B.C60的相对分子量为720
C.C60和金刚石互为同素异形体D.C60硬度比金刚石小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成分SO2)来制取石膏(CaSO42H2O)和过二硫酸钠(Na2S2O8)。设计简要流程如图:
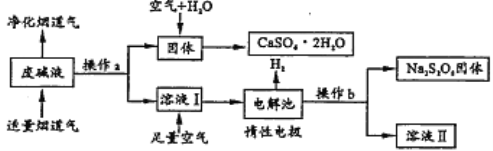
(1)烟道气中SO2与废碱生成沉淀的化学方程式为_____;操作a的名称是_____。
(2)生成CaSO42H2O过程中没有涉及到的化学反应类型为_____(填序号)。
A.复分解反应 B.化合反应 C.分解反应 D.氧化反应 E.置换反应
(3)溶液Ⅰ通入空气发生反应的化学方程式为_____。
(4)用惰性电极电解时,阳极生成Na2S2O8的电极反应为_____;在整个流程中可以循环利用的物质是H2O和_____(填化学式)。
(5)一定条件下将S8(s)、O2(g)、NaOH(s)转化过程中的能量关系用如图简单表示。则S8(s)燃烧的热化学反应方程式为_____。

(6)若制取ag Na2S2O8时,阳极有bL氧气(标况)产生。则电解生成的H2体积在标准状况下为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
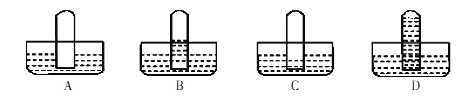
【题目】实验室用如图装置制取并收集氨气,请回答下列问题:
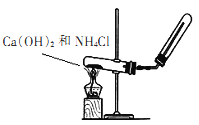
(1)写出大试管内发生反应的化学方程式:_____________。
(2)下列气体能采用如图收集方式的是___。
A.O2 B.NO C.H2
(3)若反应收集了336mL标况下氨气,将其配制成500mL溶液,其物质的量浓度为____mol/L。
(4)另取上述(3)所得溶液配制成0.0lmol/L溶液l00mL的过程中,不需要使用的仪器是(填代号)___。
A.烧杯 B.胶头滴管 C.玻璃棒 D.l00mL容量瓶 E.漏斗
(5)某学生欲试验氨气的水溶性,将集满干燥氨气的试管倒置于水中,则其观察到的现象应该与______图一致。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3反应的化学方程式:_________________________________________。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+2SO![]() +4H+。SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________。
+4H+。SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①____SeO2+____I-+____H+===____Se+____I2+____H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程式①,并标出电子转移的方向和数目。_____________
(4)实验中,准确称量SeO2样品0.150 0 g,消耗了0.200 0 mol·L-1的Na2S2O3溶液25.00 mL,所测样品中SeO2的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com