
|
检验实验室配制的FeCl2溶液是否氧化变质,应选用的最适宜的试剂是( ). | |
| [ ] | |
A. |
稀硝酸 |
B. |
KSCN溶液 |
C. |
溴水 |
D. |
酸性KMnO4溶液 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
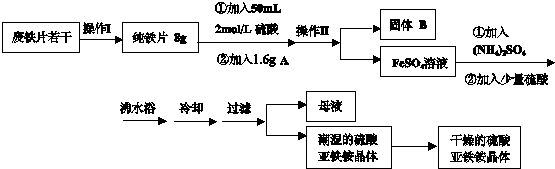
 Fe(OH)2在水中是白色沉淀,在空气中易被氧化,有关的实验现象是
Fe(OH)2在水中是白色沉淀,在空气中易被氧化,有关的实验现象是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| 操作步骤 | 实验现象 | 结论 |
| ①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置. | 试管中仍有固体物质 | 固体为 |
| ②操作①后,过滤;在滤液中加入过量的 |
有红褐色沉淀产生 | 沉淀为Fe(OH)3 |
| ③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2. | 生成物为Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源:2012届山东省聊城一中高三上学期期中考试化学试卷 题型:实验题
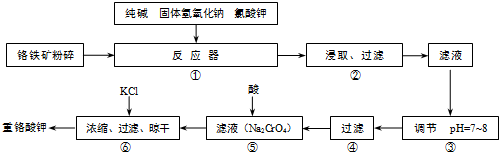
(9分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
请回答下列问题:(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号 ),检验溶液A中Fe3+的最佳试剂为 (填代号)。
),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
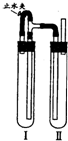
(3)由框图可知制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
(4 )欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时俯视容量瓶的刻度线,会使配制的浓度 。(填“偏高”、“偏低”、“无影响”。)
)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时俯视容量瓶的刻度线,会使配制的浓度 。(填“偏高”、“偏低”、“无影响”。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com