
获取知识和信息是现代人不可缺少的素质,信息产业的飞速发展离不开材料科学的推动。信息产业的核心材料是高纯度的硅,单晶硅可用来制作大规模集成电路、整流器等,硅纯度越高,大规模集成电路的性能就越好。高纯度的单晶硅生产方法有:
方法一:三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
方法二:用金属硅化物(Mg2Si)与盐酸作用制得硅烷,再热分解硅烷可得高纯硅。
根据上述信息回答以下问题:
(1)从方法一生产单晶硅的过程看,由焦炭还原得到的硅为何还要进一步处理?_________________________________________________________。
(2)写出方法二中生产高纯硅的两个化学方程式:
①____________________________________________________________;
②__________________________________________________________。
(3)写出由纯SiHCl3制备高纯硅的化学方程式:____________________________________。
(4)在方法一中,整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_____________________________________________________。
(5)比较方法一和方法二,分析一下各自的优缺点____________________________________。
科目:高中化学 来源: 题型:填空题
(8分)
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮化硅可用作高温陶瓷复合材料,在航空航天、汽车发动机、机械等领域有着广泛的应用。由石英砂合成氮化硅粉末的路线如下图所示:
其中-NH2中各元素的化合价与NH3相同。请回答下列问题:
(1)石英砂不能与碱性物质共同存放,以NaOH为例,用化学反应方程式表示其原因: 。
(2)图示①~⑤的变化中,属于氧化还原反应的是 。(3)SiCl4在潮湿的空气中剧烈水解,产生白雾,军事工业中用于制造烟雾剂。SiCl4水解的化学反应方程式为 。
(4)在反应⑤中,3 mol Si(NH2)4,在高温下加热可得1 mol氮化硅粉末和8 mol A气体,则氮化硅的化学式为 。
(5)在高温下将SiCl4在B和C两种气体的气氛中,也能反应生成氮化硅,B和C两种气体在一定条件下化合生成A。写出SiCl4与B和C两种气体反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.下列做法正确的是____________。
| A.将浓硝酸保存在棕色玻璃瓶中 |
| B.用镊子取出白磷并置于水中切割 |
| C.把氯酸钾制氧气后的残渣倒入垃圾桶 |
| D.氢气还原氧化铜实验先加热再通氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D、E、F、G、H可以发生如图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。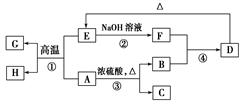
请完成以下填空:
(1)H的名称是________。
(2)E的两种用途是________、________。
(3)反应③的化学方程式是________。
(4)反应④的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯酸镁晶体[Mg(ClO3)2·6H2O]可用作棉花收获前脱叶剂、小麦催熟剂、除草剂、干燥剂。实验室制备少量Mg(ClO3)2的操作步骤如下:
(1)制备NaClO3晶体:在实验室里可用如图所示装置制取NaClO3。图中:a为氯气发生装置;b为NaClO3的制备装置;c为尾气吸收装置。
①装置a中反应的离子方程式为____________________________
②工业上用石灰乳代替烧碱溶液吸收尾气的原因是___________________________
③装置b中发生反应的化学方程式为3Cl2+6NaOH 5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
(2)制备氯酸镁晶体:由上述提纯制得的NaClO3和MgCl2按化学反应方程式计量数之比混合可制得Mg(ClO3)2,原理为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
请补充由(1)制得的NaClO3制备Mg(ClO3)2·6H2O的操作步骤:
①按计量数之比将MgCl2和NaClO3混合溶于85 ℃的热水中,加热蒸发;
②______________________;
③______________________;
④重结晶。
(3)问题讨论:①用60 ℃ Na2CO3溶液吸收Cl2也可制得NaClO3,请写出该反应的化学方程式:__________________________________________。
②制备氯酸镁晶体时最后进行重结晶操作的目的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图1是工业上“碱法烟气脱硫法” 示意图,下图2是工业上“石灰→石膏烟气脱硫法”示意图,回答:

已知:
| 试 剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请回答下列化工生产中的一些问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的郊区(填标号)。
| A.有丰富黄铁矿资源的城市 |
| B.风光秀丽的旅游城市 |
| C.消耗硫酸甚多的工业城市 |
| D.人口稠密的文化、商业中心城市 |
 2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为 ;该条件下的平衡常数为 。
2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为 ;该条件下的平衡常数为 。| 沸腾炉温度/℃ | 600 | 620 | 640 |
| 炉渣中CuSO4的质量数/% | 9.3 | 9.2 | 9.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸、硝酸和盐酸既是重要的化工原料也是化学实验室里必备的试剂。
(1)常温下,可用铝槽车装运浓硫酸,这是因为浓硫酸具有 性;硝酸应保存在棕色试剂瓶中,这是因为硝酸具有 性;敞口放置的浓盐酸浓度会减小,这是因为盐酸具有 性。
(2)①在100 mL 18 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积为13.44 L,则参加反应的铜片的质量为 (选填序号);
a.115.2 g b.76.8 g c.57.6 g d.38.4 g
②若使上述①中反应剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式: 。
(3)工业制盐酸是以电解饱和氯化钠溶液为基础进行的,该电解过程中阳极的电极反应式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com