
 A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:
A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:分析 A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.
①F的单质为生活中最常见的金属之一,原子最外层有2个电子,则F为Fe元素;
③A、D原子p轨道的电子数分别为2和4,则A核外电子排布式为1s22s22p2,则A为碳元素;D核外电子排布式为1s22s22p4,则D为氧元素.
B元素原子序数介于碳元素与氧元素之间,则B为氮元素;
②E原子价电子(外围电子)排布为msnmpn,s能级容纳2个电子,则E的价电子排布为为ms2mp2,原子序数大于氧元素,则E为Si元素.
据此结合元素化合物的性质和元素周期律解答.
解答 解:A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.
①F的单质为生活中最常见的金属之一,原子最外层有2个电子,则F为Fe元素;
③A、D原子p轨道的电子数分别为2和4,则A核外电子排布式为1s22s22p2,则A为碳元素;D核外电子排布式为1s22s22p4,则D为氧元素.
B元素原子序数介于碳元素与氧元素之间,则B为氮元素;
②E原子价电子(外围电子)排布为msnmpn,s能级容纳2个电子,则E的价电子排布为为ms2mp2,原子序数大于氧元素,则E为Si元素.
(1)F为Fe元素,Fe的稳定价态离子Fe3+的电子排布式是1s22s22p63s23p63d5;同周期主族元素从左到右第一电离能增大,但是第IIA和第IIIA,第VA和第VIA族反常,同主族从上到下第一电离能减小,所以C、N、O、Si的第一电离能由大到小的顺序为Si<C<O<N;
故答案为:1s22s22p63s23p63d5;Si<C<O<N;
(2)B为氮元素,其氢化物为NH3,NH3中N原子的杂化类型为sp3;分子的空间构型为三角锥型;NH3与H2O分子间易形成氢键,所以氨气易溶于水;
故答案为:sp3;三角锥型;NH3与H2O分子间易形成氢键;
(3)两种非金属元素的电负性差别越大,形成的共价键的极性就越大,O与C、N形成的共价键中C-O的极性大;
故答案为:C-O;
(4)A为C元素,D为O元素,黑球可以形成4个共价键,所以黑球为C,白球为O;
a.黑球在顶点、面心和晶体内部,黑球个数为$\frac{1}{8}×8+\frac{1}{2}×6+4$=8,白球全部在晶胞内部有16个,所以晶体的化学式为AD2,故a错误;
b.该晶体中有的黑球连接4个白球,有的连接2个白球,所以A、D原子间形成的是单键和双键,故b错误;
c.该晶体为空间网状结构,为原子晶体,C原子半径小于Si,所以熔点可能比SiO2晶体高,故c正确;
d.该晶体为原子晶体,原子晶体难溶于水,故d错误.
故答案为:c.
点评 本题考查结构性质位置关系、电子排布式、化学键、晶胞结构与计算等,侧重于学生的分析能力和计算能力的考查,难度中等,推断元素是解题关键,注意利用均摊法进行晶胞的计算.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 分液、蒸馏、萃取 | C. | 萃取、蒸馏、分液 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
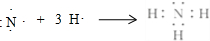 ;
;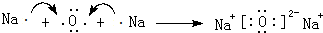 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固态>液态>气态 | B. | 液态>固态>气态 | C. | 气态>液态>固态 | D. | 气态>固态>液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
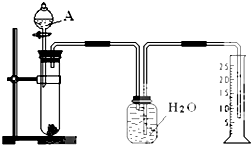 某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数.可供选用的试剂有:浓H2SO4、浓硝酸、6mol•L-1NaOH溶液.请填写下列空白:
某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数.可供选用的试剂有:浓H2SO4、浓硝酸、6mol•L-1NaOH溶液.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发结晶操作时,当有大量晶体析出时停止加热,用余热蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球插入液态混合物中 | |
| C. | 分液操作时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 | |
| D. | 萃取操作时,萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为KClO4(s)+8e?═KCl(s)+4O2?(l) | |
| B. | 在该热电池中,铁为负极,发生还原反应 | |
| C. | △H参与反应的高氯酸钾越多,其值越小 | |
| D. | 生成1 mol FeO转移8 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com