
下列实验基本操作或说法正确的是 (填写序号)
A、用50ml的量筒量取5.2ml稀硫酸
B、为了有效地除去粗盐中的Ca2+ 、Mg2+ 、SO42-,可先加入NaOH,再加入BaCl2,最后加入Na2CO3,将沉淀过滤后,再用HCl调整溶液至中性
C、石蕊试纸或PH试纸使用前都应用蒸馏水润湿
D、稀释浓硫酸时,应将水沿器壁缓缓加入浓硫酸中,并不断用玻璃棒搅拌
E、容量瓶中含有少量蒸馏水,对配制一定物质的量浓度的硫酸溶液无影响
F、将饱和FeC13溶液滴加沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体;
G、乙酸乙酯制备收集完毕,分液时,直接将乙酸乙酯从分液漏斗的上口倒出
H、在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
科目:高中化学 来源: 题型:
二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
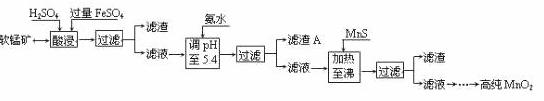
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥–0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为  。
。
(2)滤渣A的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰电池中可以回收利用的物质有 (写两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,盐酸既表现出还原性又表现出酸性的是( )。
A.CaCO3+2HCl==CaCl2+H2O+CO2↑
B.Fe+2HCl===FeCl2+H2↑
C.MnO2+4HCl (浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.NaOH+HCl==NaCl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性是顺序为SO2 > I- > Fe2+ > H2O2> Cl-,则下列反应不可能发生的是( )
A.2Fe2++Cl2=2Fe3++2Cl-
B.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
C.H2O2+H2SO4=SO2↑+O2↑+2H2O
D.SO2+I2+2H2O=H2SO4+2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应最终能生成Fe3+的化合物的是( )
①过量Fe与HNO3 ② 铁丝在硫蒸汽中燃烧 ③向FeBr2溶液中通入Cl2 ④铁与CuCl2溶液反应 ⑤Fe(OH)2露置于空气中
A.①②③ B.①③⑤ C.③④ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置E的作用是 。装置F中为 溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是__________________________,写出有关离子方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用石墨做电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状况( )
A.CuSO4 B.CuO
C.Cu(OH)2 D.CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
有机化合物G是合成维生素类药物的中间体,其结构简式如图所示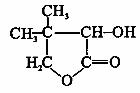 ,G的合成路线如下图所示:
,G的合成路线如下图所示:
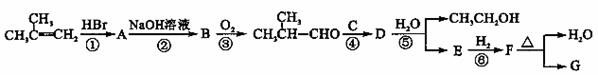
其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去
已知: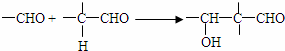
请回答下列问题:
(1)G的分子式是 ,G中官能团的名称是 ;
(2)第②步反应的化学方程式是 ;
(3)B的名称(系统命名)是 ;
(4)第②~⑥步反应中属于取代反应的有 (填步骤编号);
(5)第④步反应的化学方程式是 ;
(6)写出同时满足下列条件的E的所有同分异构体的结构简式 。
① 只含一种官能团;②链状结构且无-O-O-;③核磁共振氢谱只有2种峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a | |||||||||||||||||
| b | c | d | |||||||||||||||
| e | f | ||||||||||||||||
| g | |||||||||||||||||
请回答下列问题:
(1)已知互为等电子体的分子具有相似的价键结构,写出由上述元素组成与c的单质互为等电子体的电子式(任一种): ;
(2) g元素在周期表中的位置是 ;
(3) c、d元素的氢化物的沸点较高的是 (填化学式),其理由是________________________________________________________________________;
(4) 用电子式描述a~g中电负性最大和最小的元素形成化合物的过程:
;
(5) 写出由a、b、c、d元素组成,原子个数比为5∶1∶1∶3的化合物与足量烧碱稀溶液反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com