
【题目】某有机物完全燃烧生成标准状况下CO2的体积为4.48 L,H2O的质量为5.4 g ,
(1)若此有机物的质量为3 g,则此有机物的结构简式是_________________________;
(2)若此有机物的质量为4.6 g,则此有机物的分子式是________________________;
(3)若此有机物的质量为6.2 g,且此有机物1mol能和金属钠反应生成1 mol H2,则此有机物的结构简式是______________________________。
【答案】 CH3CH3 C2H6O HOCH2CH2OH
【解析】(1)生成水的物质的量为:n(H2O)= ![]() =0.3mol,n(H)=n(H2O)×2=0.6mol,m(H)=0.6g;生成二氧化碳的物质的量为:n(CO2)=
=0.3mol,n(H)=n(H2O)×2=0.6mol,m(H)=0.6g;生成二氧化碳的物质的量为:n(CO2)= ![]() =0.2mol,n(C)=n(CO2)=0.2mol,m(C)=2.4g,m(C)+m(H)=3g,因有机物的质量为3g,所以有机物中没有氧元素,则有机物的实验式为C2H6,因碳原子已饱和,所以分子式为C2H6,故答案为:CH3CH3;
=0.2mol,n(C)=n(CO2)=0.2mol,m(C)=2.4g,m(C)+m(H)=3g,因有机物的质量为3g,所以有机物中没有氧元素,则有机物的实验式为C2H6,因碳原子已饱和,所以分子式为C2H6,故答案为:CH3CH3;
(2)m(C)+m(H)=3g,因有机物的质量为4.6g>3g,所以有机物中含有氧元素,氧元素的质量为:4.6g-3g=1.6g,氧元素的物质的量为:n(O)= ![]() =0.1mol,则有机物的实验式为C2H6O,因碳原子已饱和,所以分子式为C2H6O,故答案为:C2H6O;
=0.1mol,则有机物的实验式为C2H6O,因碳原子已饱和,所以分子式为C2H6O,故答案为:C2H6O;
(3)m(C)+m(H)=3g,因有机物的质量为6.2g,所以有机物中含有氧元素,氧元素的质量为:6.2g-3g=3.2g,n(O)= ![]() =0.2mol,则有机物的实验式为C2H6O2,因碳原子已饱和,所以分子式为C2H6O2,因1molC2H6O2能和金属钠反应生成1molH2,所以C2H6O2中含有两个羟基,该有机物的结构简式为:HOCH2CH2OH,故答案为:HOCH2CH2OH。
=0.2mol,则有机物的实验式为C2H6O2,因碳原子已饱和,所以分子式为C2H6O2,因1molC2H6O2能和金属钠反应生成1molH2,所以C2H6O2中含有两个羟基,该有机物的结构简式为:HOCH2CH2OH,故答案为:HOCH2CH2OH。


科目:高中化学 来源: 题型:
【题目】分别用浓度均为0.5mol/L的NH3·H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是
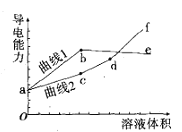
A. 曲线2 代表滴加NH3·H2O溶液的变化曲线
B. b和d点对应的溶液均显碱性
C. b点溶液中c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D. df段导电能力升高的原因是发生了反应Al(OH)3+OH-=[Al(OH)4]-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液含有HCO3-、CO32-、SO32-、NO3-中的5种离子,若向其中加入Na2O2粉末,充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变是( )
A.NO3- B.CO32-、 NO3- C.SO32-、NO3- D.CO32-、Na+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。

图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。
(1)在上述装置中,实验时需要加热的仪器为(填仪器或某部位的代号) _____________________。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是_____________。
(3)检验乙醇氧化产物时F中的实验现象是____________________________。
(4)E处是一种纯净物,其反应方程式为_______________________________________。
(5)写出乙醇发生催化氧化的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含下列离子的溶液中分别加入NaOH固体(溶液体积不变),能引起离子浓度减小的是
A. Cl- B. OH- C. AlO2- D. HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L的戊烷所含的分子数大于0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2L二氯甲烷所含分子数为0.5NA
D. 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂,下图为制备粗高铁酸钾的工业流程。
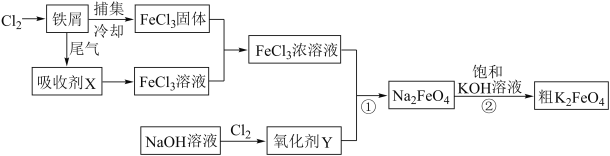
请回答下列问题:
(1)氯化铁做净水剂的原因是(结合化学用语表达) 。
(2)吸收剂X的化学式为 ,氧化剂Y的化学式为 。
(3)碱性条件下反应①的离子方程式为 。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因 。
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是 。
(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点。以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化物的叙述正确的是
A. 金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B. 酸性氧化物都能与水化合生成酸
C. 碱性氧化物都能与水化合生成碱
D. 碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com