
【题目】氯化铁和高铁酸钾都是常见的水处理剂,下图为制备粗高铁酸钾的工业流程。
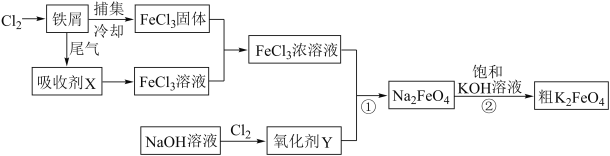
请回答下列问题:
(1)氯化铁做净水剂的原因是(结合化学用语表达) 。
(2)吸收剂X的化学式为 ,氧化剂Y的化学式为 。
(3)碱性条件下反应①的离子方程式为 。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因 。
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是 。
(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点。以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式 。
【答案】
(1)Fe3+ +3H2O![]() Fe(OH)3+3H+;水解产生的Fe(OH)3胶体能够吸附杂质;
Fe(OH)3+3H+;水解产生的Fe(OH)3胶体能够吸附杂质;
(2)FeCl2;NaClO
(3)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
(4)K2FeO4溶解度小于NaFeO4,析出晶体,促进反应进行
(5)B;高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率
(6)FeO42- + 3e- + 4SO3 = Fe3+ + 4SO42-
【解析】
试题分析:(1)氯化铁水解生成的氢氧化铁胶体具有吸附性,能够吸附杂质可做净水剂,故答案为:Fe3+ +3H2O![]() Fe(OH)3+3H+;水解产生的Fe(OH)3胶体能够吸附杂质;
Fe(OH)3+3H+;水解产生的Fe(OH)3胶体能够吸附杂质;
(2)根据流程图,吸收剂X吸收氯气后能够生成氯化铁,因此X为氯化亚铁,氢氧化钠与氯气反应生成氧化剂Y,因此氧化剂Y为次氯酸钠,故答案为:FeCl2;NaClO;
(3)碱性条件下,氯化铁与次氯酸钠反应生成高铁酸钠,因此反应①的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)由于K2FeO4溶解度小于NaFeO4,析出晶体,促进2KOH+NaFeO4=K2FeO4+2NaOH反应进行,故答案为:K2FeO4溶解度小于NaFeO4,析出晶体,促进反应进行;
(5)由于4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用碱性溶液,故选B;除了氢氧化钠外,一般工业生产还要加入异丙醇作为洗涤剂,是因为高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率,故答案为:B;高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率;
(6)高铁酸钾具有氧化性,在设计的电池中发生还原反应,二氧化硫具有还原性,能够发生氧化反应,生成三氧化硫,因此电池的正极反应式为FeO42- + 3e- + 4SO3 = Fe3+ + 4SO42-,故答案为:FeO42- + 3e- + 4SO3 = Fe3+ + 4SO42-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:
【题目】室温下,将0.05molNa2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
加入的物质 | 结论 | |
A | 50mL1 mol·L-1硫酸 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05molNa2O2 | 溶液中 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH-)不变 |
D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是
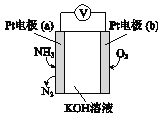
A. O2在电极b上发生还原反应
B. 反应消耗的NH3与O2的物质的量之比为4:5
C. 溶液中OH-向电极a移动
D. 负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业合成氨的原理是N2(g)+3H2(g)=2NH3(g) △H=-93.0kJ/mol
(1)已知一定条件下:2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H=-+1530.0kJ/mol。则氢气燃烧热的热化学方程式为_________________。
(2)如下图,在恒温恒容装置中进行合成氨反应。

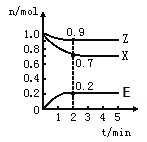
①表示N2浓度变化的曲线是_________。
②前25min内,用H2浓度变化表示的化学反应速率是_____________。
③在25min末刚好平衡,则平衡常数K=___________。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是_______________。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应为:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H<0
副反应为:2NH3(g)+8NO(g)=5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如下图所示。

请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是______,导致这种规律的原因是_________(任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3+3O2=2N2+6H2O。则负极电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是短周期主族元素中的四种非金属元素,它们的原子序数依次增大。X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出Z在元素周期表中的位置________。
(2)一定温度下,在2 L的密闭容器中,X的单质和Z的单质反应生成E。物质的量随时间变化的曲线如右图所示,从反应开始到2min时,用E表示的反应速率为__________,Z的转化率为__________。
(3)由X、Z、W三种元素组成的某种盐是一种速效化肥,该盐阳离子电子式为_____________________;由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为______________________。
(4)工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式___________________________。该反应中被氧化的E与参与反应的E的质量之比________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气体在标准状况下体积是4.48L,质量是14.2 g,该气体的摩尔质量是
A.71 B.71 gmol﹣1 C.28.4 D.28.4 gmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属钠的说法中,错误的是( )
A. 钠应保存在煤油中 B. 钠与氧气反应的产物与反应条件有关
C. 钠在反应中易失去电子,表现出还原性 D. 钠只有在加热条件下能与氯气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知通常状况下A为最轻的气体,B为呈黄绿色气体,D是能使湿润的紫色石蕊试纸变蓝的气体。E、F为固体,G为氯化钙,它们之间的转化关系如图所示:
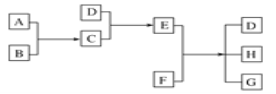
(1) D的化学式是__________,C的化学式是__________。
(2) 请写出E的电子式______________________。
(3) A与B反应生成C的化学方程式是______________________。
(4) E与F反应生成D、H和G的化学方程式是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com