
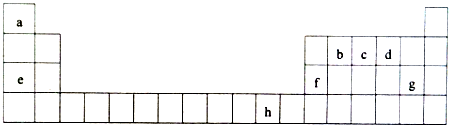
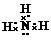 ,分子中c原子的杂化轨道类型是sp3杂化;Ca3特别易溶于a2d,其原因是NH3和H2O之间能形成氢键(3)h2+可以与Ca3以配位键形成[h(Ca3)4]2+离子,在水溶液中否(能、否)完全电离.
,分子中c原子的杂化轨道类型是sp3杂化;Ca3特别易溶于a2d,其原因是NH3和H2O之间能形成氢键(3)h2+可以与Ca3以配位键形成[h(Ca3)4]2+离子,在水溶液中否(能、否)完全电离.分析 根据元素在周期表中的相对位置可知:a为H、b为C、c为N、d为O、e为Na、f为Al、g为Cl、h为Cu,
(1)d为氧元素,氧原子的核外电子总数为8,据此写出其核外电子排布式;
(2)ca3的为NH3,氨气为共价化合物,分子中含有3个氮氢键;氨气为三角锥形,N原子采用sp3杂化;氨气能够与水分子形成氢键,所以极易溶于水;
(3)氨气中的N原子能单方提供孤对电子形成配位键,则在溶液中不能完全电离;
(4)d和e能形成1:1化合物为过氧化钠,过氧化钠中含有离子键和共价键;
(5)bg4为四氯化碳,为非极性键组成的非极性分子;根据金属性越强,第一电离能越小,非金属性越强,第一电离能越大进行判断.
解答 解:根据元素在周期表中的相对位置可知:a为H、b为C、c为N、d为O、e为Na、f为Al、g为Cl、h为Cu,
(1)d为O元素,氧原子核外电子总数为8,其核外电子排布式为:1s22s22p4,
故答案为:1s22s22p4;
(2)ca3的为NH3,氨气为共价化合物,其电子式是其电子式为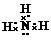 ,氨气为三角锥形,σ键数为3,孤对电子数为1,则N原子为杂化sp3;a2d为水,氨气与水分子间能够形成氢键,所以氨气极易溶于水,
,氨气为三角锥形,σ键数为3,孤对电子数为1,则N原子为杂化sp3;a2d为水,氨气与水分子间能够形成氢键,所以氨气极易溶于水,
故答案为: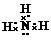 ;sp3杂化;NH3和H2O之间能形成氢键;
;sp3杂化;NH3和H2O之间能形成氢键;
(3)氨气中的N原子能单方提供孤对电子,与铜离子提供的空轨道形成配位键,所以在溶液中不能完全电离,
故答案为:配位键;否;
(4)d和e能形成1:1化合物为过氧化钠,过氧化钠为离子化合物,其化学式中既存在离子键,也含有非极性共价键,
故答案为:共价键(非极性共价键)、离子键;
(5)bg4为四氯化碳,四氯化碳为正四面体结构,将键的极性抵消,所以四氯化碳为非极性分子;
e为Na、f为Al、g为Cl,金属性最强的为Na、非金属性最强的为Cl,则第一电离能最小的为Na、最大的为Cl,所以三者的第一电离能由大到小的顺序为:C1、A1、Na,
故答案为:非极性;C1、A1、Na.
点评 本题考查位置、结构、性质,涉及元素周期表和元素周期律的综合应用,涉及电子排布、杂化类型、第一电离能等知识,题目难度中等,综合性较强,明确元素在周期表中的位置是解答本题的关键,然后利用物质结构及其性质来解答即可.


科目:高中化学 来源: 题型:选择题
| A. | 甘油和水、乙醛和水、乙酸和乙醇 | |
| B. | 油酸和水、甲苯和水、己烷和苯 | |
| C. | 乙酸乙酯和水、酒精和水、苯酚和水 | |
| D. | 二溴乙烷和水、溴苯和水、硝基苯和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和Na2CO3溶液 | B. | CaCl2溶液 | C. | Na2SiO3溶液 | D. | Ca(ClO)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
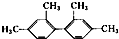 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 该烃属于苯的同系物 | |
| B. | 分子中至少有16个碳原子处于同一平面上 | |
| C. | 分子中至少有9个碳原子处于同一平面上 | |
| D. | 分子中至少有11个碳原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IVA族元素氢化物熔点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物熔点顺序也是:AsH3>PH3>NH3 | |
| B. | 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| C. | 工业上用电解氯化镁制备镁单质,工业上也可用电解氯化铝制备铝单质 | |
| D. | Fe3O4可改写成氧化物的形式为:FeO•Fe2O3;因此Pb3O4也可改写为:PbO•Pb2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
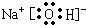 ,该化合物中化学键类型有离子键和共价键.
,该化合物中化学键类型有离子键和共价键.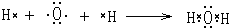 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏产物全部是有机物 | |
| B. | 石油的分馏、煤的干馏都属于化学变化 | |
| C. | 煤焦油经过分馏可以得到苯、甲苯等,说明煤中含有苯和甲苯 | |
| D. | 石油的裂化、裂解说明烃在加热条件下是可以分解的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com