
【题目】下列各组微粒的空间构型相同的是( ) ①NH3和H2O
②NH ![]() 和H3O+
和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和BeCl2
⑥NH ![]() 和SO42﹣
和SO42﹣
⑦BF3和Al2Cl6 .
A.全部
B.除④⑥⑦以外
C.③④⑤⑥
D.②⑤⑥
【答案】C
【解析】解:①NH3中价层电子对个数=3+ ![]() ×(5﹣3)=4且含有一个孤电子对,所以为三角锥形,H2O中价层电子对个数=2+
×(5﹣3)=4且含有一个孤电子对,所以为三角锥形,H2O中价层电子对个数=2+ ![]() ×(6﹣2)=4且含有两个孤电子对,所以为V形结构,二者空间构型不同,故①错误; ②NH4+中价层电子对个数是4且不含孤电子对,为正四面体形结构;H3O+中O原子价层电子对个数=3+
×(6﹣2)=4且含有两个孤电子对,所以为V形结构,二者空间构型不同,故①错误; ②NH4+中价层电子对个数是4且不含孤电子对,为正四面体形结构;H3O+中O原子价层电子对个数=3+ ![]() (6﹣1﹣3×1)=4且含有一个孤电子对,所以为三角锥形结构,二者空间构型不同,故②错误;
(6﹣1﹣3×1)=4且含有一个孤电子对,所以为三角锥形结构,二者空间构型不同,故②错误;
③NH3为三角锥形结构、H3O+中O原子价层电子对个数=3+ ![]() (6﹣1﹣3×1)=4且含有一个孤电子对,所以为三角锥形结构,所以二者空间构型相同,故③正确;
(6﹣1﹣3×1)=4且含有一个孤电子对,所以为三角锥形结构,所以二者空间构型相同,故③正确;
④O3、SO2中价层电子对个数都是3且都含有一对孤电子对,所以分子空间构型都是V形,故④正确;
⑤CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+ ![]() (4﹣2×2)=2,所以二氧化碳是直线型结构,BeCl2中Be价层电子对=σ 键电子对+中心原子上的孤电子对=2+
(4﹣2×2)=2,所以二氧化碳是直线型结构,BeCl2中Be价层电子对=σ 键电子对+中心原子上的孤电子对=2+ ![]() (2﹣2)=2,是sp杂化,是直线型结构,二者空间构型相同,故⑤正确;
(2﹣2)=2,是sp杂化,是直线型结构,二者空间构型相同,故⑤正确;
⑥NH4+和SO42﹣中价层电子对个数都是4且不含孤电子对,所以空间构型都是正四面体结构,所以空间构型相同,故⑥正确;
⑦BF3中B原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以分子构型为平面正三角形,气态氯化铝通常以二聚分子形式存在,Al2Cl6结构  ,Al采用sp3杂化轨道成键,为正四面体结构,二者空间构型不同,故⑦错误;
,Al采用sp3杂化轨道成键,为正四面体结构,二者空间构型不同,故⑦错误;
故选C.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】为了缓解温室效应,科学家提出了多种回收和利用CO2的方案。
方案I:利用FeO吸收CO2获得H2
i.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △Hl=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)==CO2(g)+2H2(g) △H2=+113.4kJ/mol (1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H3=__________。
(2)在反应i中,每放出38.0kJ热量,有______gFeO被氧化。
方案II:利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2mol CO2和8molH2,发生反应CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。

(3) ①从反应开始到恰好达到平衡时,H2的平均反应速率v(H2)=________。
②300℃时,反应的平衡常数K=________。
③保持温度不变,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度_______(填字母)。
A.等于0.8mol/L B.等于1.6mol/L
C.0.8 mol/L <c(CH4)<1.6 mol/L D.大于1.6 mol/L
(4)300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g),则v正____v逆(填“>”“<”或“=”)。
(5)已知:200℃时.该反应的平衡常数K=61.8L2·mol-2。则△H4___0(填“>”“<”或“=”)。
方案Ⅲ:用碱溶液吸收CO2
利用100mL3mol/LNaOH溶液吸收4.48LCO2(标准状况),得到吸收液。
(6)该吸收液中离子浓度的大小排序为____________。将该吸收液蒸干,灼烧至恒重,所得固体的成分是_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,把一个盛有一定量甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体发生反应,下列叙述正确的是
①容器内压强不变 ②容器内分子总数不变 ③容器内原子总数不变 ④容器内发生的反应是取代反应⑤16 g甲烷与足量Cl2在光照条件下反应,生成四氯甲烷的分子数为NA
A. ①②③ B. ②③ C. ③④⑤ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=3的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。下列说法不正确的是

A. 曲线I代表盐酸的稀释过程
B. a溶液的导电性比b溶液的导电性强
C. b溶液中和氢氧化钠的能力强于a溶液
D. 将a、b两溶液加热至30℃, 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中可存在电离平衡,水解平衡,溶解平衡,依据所学回答下列问题.
(1)等物质的量浓度的下列四种溶液:①NH3H2O ②(NH4)2SO3 ③KHSO3 ④K2SO3溶液中水的电离程度由大到小的排列顺序为(填序号).
(2)体积相同、c(H+)相同的三种酸溶液①CH3COOH;②HCl;③H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是(填序号).将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为(填序号).
(3)已知,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ/mol.实验测得稀醋酸与稀NaOH溶液反应生成1mol H2O时放出57kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为 .
(4)25℃时,NH3H2O的电离常数为Kb=1.7×10﹣3 . 0.1molL﹣1NH4Cl溶液的pH=a,则c(NH4+):c(NH3H2O)=(用含a的代数式表示)
(5)某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),其中正确的有①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低②pH=2的盐酸与pH=13的NaOH溶液,按体积比9:1混合后的溶液pH为11
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH.其溶液物质的量浓度由小到大顺序为c、b、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42﹣)
⑤亚磷酸(H3PO3)是二元弱酸,所以Na2HPO3稀溶液一定呈碱性
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7.
⑦某二元酸在水中的电离方程式是H2B═H++HB﹣;HB﹣H++B2﹣ , 则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
(6)25℃时Ksp[Mg(OH)2]=5.6×10﹣12 , Ksp[Cu(OH)2]=2.2×10﹣20 , Ksp[Fe(OH)3]=4.0×10﹣38 , Ksp[Al(OH)3]=1,.1×10﹣33 . 在25℃下,向浓度均为0.1molL﹣1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式).现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2molL﹣1 . 此时所得沉淀中(填“还含有”或“不含有”)Al(OH)3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法中正确的是( )
A. 由上述信息可推知河虾中的砷被还原
B. 因为河虾中含有砷元素,所以不能食用
C. 上述反应中维生素C作氧化剂
D. 在该反应中维生素C作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol/L、100mL的Ba(OH)2溶液中,分别滴入浓度均为0.1mol/L的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。
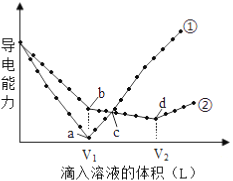
(1) 0.1mol/L的NaHSO4溶液pH=_____________。
(2)曲线___________代表滴加H2SO4溶液的变化曲线。b点溶液的酸碱性为___________(酸性或碱性或中性)。
(3)d点溶液中主要离子种类:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0L恒容密闭容器中充入2mol SO2和1mol O2 , 发生反应: 2SO2(g)+O2(g)2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前t1 s 的平均速率v(O2)= ![]() ?mol?L﹣1?s﹣1
?mol?L﹣1?s﹣1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.相同温度下,起始时向容器中充入4mol SO3 , 达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2mol SO2、1mol O2 , 反应达到新平衡时 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质用途的说法不正确的是( )
A.二氧化硅是制作光导纤维的材料
B.氢氧化铁胶体可用作净水剂
C.碳酸氢钠可用于治疗胃酸过多
D.二氧化碳可用作镁燃烧的灭火剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com