
【题目】常温下,浓度均为0.1mol/L、100mL的Ba(OH)2溶液中,分别滴入浓度均为0.1mol/L的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。
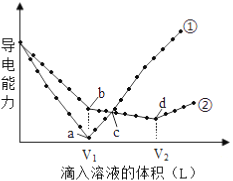
(1) 0.1mol/L的NaHSO4溶液pH=_____________。
(2)曲线___________代表滴加H2SO4溶液的变化曲线。b点溶液的酸碱性为___________(酸性或碱性或中性)。
(3)d点溶液中主要离子种类:______________。
【答案】 1 ① 碱性 Na+、SO42-
【解析】试题分析:本题考查溶液pH的计算,酸碱混合后导电能力图像的分析,离子反应和溶液酸碱性的判断。
(1)NaHSO4属于强酸的酸式盐,其在水溶液中的电离方程式为NaHSO4=Na++H++SO42-,0.1mol/LNaHSO4溶液中c(H+)=0.1mol/L,溶液的pH=1。
(2)Ba(OH)2溶液中加入H2SO4发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O;Ba(OH)2溶液中加入NaHSO4溶液,随着NaHSO4的加入依次发生反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH、NaOH+NaHSO4=Na2SO4+H2O;当Ba(OH)2与H2SO4恰好完全反应时,溶液中离子物质的量浓度最小且接近0,导电能力最小接近0,曲线①中a点导电能力最小接近0,则曲线①代表滴加H2SO4溶液的变化曲线;曲线②代表滴加NaHSO4溶液的变化曲线。b点在曲线②上,a点在曲线①上,b点与a点加入的溶液体积相等,a点Ba(OH)2与H2SO4恰好完全反应,Ba(OH)2与H2SO4物质的量相等,则b点Ba(OH)2与NaHSO4物质的量相等,发生反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,b点为NaOH溶液,b点溶液呈碱性。
(3)d点在曲线②上,导电能力最小,d点Ba(OH)2与NaHSO4的反应为Ba(OH)2+2NaHSO4=BaSO4↓+2H2O+Na2SO4,d点为Na2SO4溶液,溶液中主要离子为Na+、SO42-。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)中国古代四大发明之一﹣﹣黑火药,它的爆炸反应为:2KNO3+3C+S ![]() A+N2↑+3CO2↑(已配平) ①除S外,上述元素的电负性从大到小依次为;
A+N2↑+3CO2↑(已配平) ①除S外,上述元素的电负性从大到小依次为;
②在生成物中,含极性共价键的分子的中心原子轨道杂化类型为 , A的晶体类型为 .
③已知CN﹣与N2结构相似,推算HCN分子中σ键与π键数目之比为 .
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2;T的基态原子外围电子(价电子)排布为 , Q2+的未成对电子数是 .
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6﹣n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R﹣H),可发生离子交换反应:[CrCln(H2O)6﹣n]x++xR﹣H→Rx[CrCln(H2O)6﹣n]+xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成.将含0.0015mol[CrCln(H2O)6﹣n]x+的溶液,与R﹣H完全交换后,中和生成的H+需浓度为0.1200molL﹣1NaOH溶液25.00mL,可知该配离子的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1mol链烃CxHy可以发生如上系列转化:(无机试剂是足量的)下列说法错误的是
![]()
A. x=5、n=10
B. 用酸性高锰酸钾溶液可以区分CxHy和Q
C. 上述转化过程中依次发生了加成反应和取代反应
D. Q的同分异构体数目少于CxH12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒的空间构型相同的是( ) ①NH3和H2O
②NH ![]() 和H3O+
和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和BeCl2
⑥NH ![]() 和SO42﹣
和SO42﹣
⑦BF3和Al2Cl6 .
A.全部
B.除④⑥⑦以外
C.③④⑤⑥
D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。

①分析数据可知:大气固氮反应属于_________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因_________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因____________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下图所示的图示中,正确的是_______(填“A”或“B”);比较p1、p2的大小关系________,理由____________。

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是___________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g),则其反应热△H=__________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H=__________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1,2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1,2H2(g)+O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1)
2H2O(l) △H=-571.6kJ·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存,且加入过量稀硫酸时,有气体生成的是( )
A. Na+ 、Ag+ 、CO32- 、Cl- B. H+ 、K+、NH4+、OH-
C. Na+ 、K+ 、CO32- 、Cl- D. Na+ 、K+ 、Cl- 、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 T、Q、R、W 在元素周期表中的位置如图所示,其中 T 所处的周期序数与主族 族序数相等.它们的最高价氧化物水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )
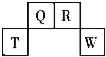
A. 甲、乙、丙、丁受热均易分解
B. 常温下丁的浓溶液可用 T 单质所制的容器来盛装
C. 丁的浓溶液与 Q 的单质加热发生反应,可生成体积比为 1:2 的两种气体
D. R 的氧化物在空气中与其它物质作用可形成光化学烟雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,下列五种溶液:①0.1mol/LNH4Cl②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4 ④0.1mol/L NH3H2O和0.1mol/LNH4Cl混合液⑤0.1mol/LNH3H2O,请根据要求填写下列空白:
(1)溶液①呈性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是;c(NH4+)最小的是(填序号)
(3)比较溶液②、③中c(NH4+)的大小关系是②③(填“>”、“<”或“=”)
(4)在溶液④中,离子的浓度为0.1mol/L;NH3H2O和离子的物质的量浓度之和为0.2mol/L
(5)常温下,测得溶液②的pH=7,则说明CH3COO﹣的水解程度(填“>”、“<”或“=”)NH4+ 的水解程度,CH3COO﹣与NH4+浓度的大小关系是:c(CH3COO﹣)c(NH ![]() )(填“>”、“<”或“=”)
)(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com