
【题目】已知1mol链烃CxHy可以发生如上系列转化:(无机试剂是足量的)下列说法错误的是
![]()
A. x=5、n=10
B. 用酸性高锰酸钾溶液可以区分CxHy和Q
C. 上述转化过程中依次发生了加成反应和取代反应
D. Q的同分异构体数目少于CxH12
【答案】D
【解析】由![]() 可知,CxHy与HCl以1:2加成反应,Q与氯气光照下取代为1:1反应,光照时发生10个H被10个Cl取代,则n=10,即Q中含10个H,加成时引入2个H,则y=8,结合链烃CxHy的不饱和度为2,则可知x=5,即CxHy为C5H8,Q为C5H10Cl2,以此来解答.A. 由上述分析可知,x=5,n=10,A正确;B.Q为饱和结构,CxHy含碳碳双键或三键能使高锰酸钾褪色,则用酸性高锰酸钾溶液可以区分CxHy和Q,B正确;C.
可知,CxHy与HCl以1:2加成反应,Q与氯气光照下取代为1:1反应,光照时发生10个H被10个Cl取代,则n=10,即Q中含10个H,加成时引入2个H,则y=8,结合链烃CxHy的不饱和度为2,则可知x=5,即CxHy为C5H8,Q为C5H10Cl2,以此来解答.A. 由上述分析可知,x=5,n=10,A正确;B.Q为饱和结构,CxHy含碳碳双键或三键能使高锰酸钾褪色,则用酸性高锰酸钾溶液可以区分CxHy和Q,B正确;C.![]() 为加成反应,
为加成反应,![]() 为取代反应,C正确;D.Q为C5H10Cl2,CxH12为C5H12,Q可看成C5H12中的氢原子被Cl取代,则Q的同分异构体数目大于CxH12,D错误;答案选D.
为取代反应,C正确;D.Q为C5H10Cl2,CxH12为C5H12,Q可看成C5H12中的氢原子被Cl取代,则Q的同分异构体数目大于CxH12,D错误;答案选D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,下列叙述正确的是
A. 单质的还原性:A>B>D>C B. 离子半径:C>D>B>A
C. c-a=5 D. 原子半径:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3溶液中存在水解平衡:CO32﹣+H2OHCO3﹣+OH﹣ . 下列说法不正确的是( )
A.通入CO2 , 溶液pH减小
B.加入少量NH4Cl固体,平衡向正反应方向移动
C.慢慢升高温度, ![]() 逐渐减小
逐渐减小
D.加入NaOH 固体后冷却到室温,溶液的KW=c(OH﹣)?c(H+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,把一个盛有一定量甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体发生反应,下列叙述正确的是
①容器内压强不变 ②容器内分子总数不变 ③容器内原子总数不变 ④容器内发生的反应是取代反应⑤16 g甲烷与足量Cl2在光照条件下反应,生成四氯甲烷的分子数为NA
A. ①②③ B. ②③ C. ③④⑤ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四元轴烯(a)、苯乙烯(b)\、立方烷(c)的分子式均为C8H8,下列说法正确的是
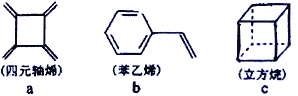
A. a 的同分异构体只有b 和c两种
B. a、b、c均能使溴的四氯化碳溶液褪色
C. a、b分子中的所有原子一定处于同一平面
D. a、c的二氯代物有3种,b的一氯代物有5 种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=3的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。下列说法不正确的是

A. 曲线I代表盐酸的稀释过程
B. a溶液的导电性比b溶液的导电性强
C. b溶液中和氢氧化钠的能力强于a溶液
D. 将a、b两溶液加热至30℃, 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中可存在电离平衡,水解平衡,溶解平衡,依据所学回答下列问题.
(1)等物质的量浓度的下列四种溶液:①NH3H2O ②(NH4)2SO3 ③KHSO3 ④K2SO3溶液中水的电离程度由大到小的排列顺序为(填序号).
(2)体积相同、c(H+)相同的三种酸溶液①CH3COOH;②HCl;③H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是(填序号).将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为(填序号).
(3)已知,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ/mol.实验测得稀醋酸与稀NaOH溶液反应生成1mol H2O时放出57kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为 .
(4)25℃时,NH3H2O的电离常数为Kb=1.7×10﹣3 . 0.1molL﹣1NH4Cl溶液的pH=a,则c(NH4+):c(NH3H2O)=(用含a的代数式表示)
(5)某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),其中正确的有①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低②pH=2的盐酸与pH=13的NaOH溶液,按体积比9:1混合后的溶液pH为11
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH.其溶液物质的量浓度由小到大顺序为c、b、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42﹣)
⑤亚磷酸(H3PO3)是二元弱酸,所以Na2HPO3稀溶液一定呈碱性
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7.
⑦某二元酸在水中的电离方程式是H2B═H++HB﹣;HB﹣H++B2﹣ , 则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
(6)25℃时Ksp[Mg(OH)2]=5.6×10﹣12 , Ksp[Cu(OH)2]=2.2×10﹣20 , Ksp[Fe(OH)3]=4.0×10﹣38 , Ksp[Al(OH)3]=1,.1×10﹣33 . 在25℃下,向浓度均为0.1molL﹣1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式).现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2molL﹣1 . 此时所得沉淀中(填“还含有”或“不含有”)Al(OH)3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol/L、100mL的Ba(OH)2溶液中,分别滴入浓度均为0.1mol/L的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。
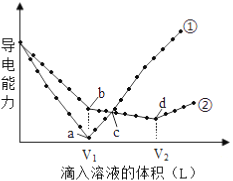
(1) 0.1mol/L的NaHSO4溶液pH=_____________。
(2)曲线___________代表滴加H2SO4溶液的变化曲线。b点溶液的酸碱性为___________(酸性或碱性或中性)。
(3)d点溶液中主要离子种类:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Na2SO3固体与硫酸可发生反应:Na2SO3+ H2SO4=Na2SO4+H2O+SO2↑,下图是实验室制取SO2并验证SO2的某些性质的装置图。回答正确的是( )

A. ①中的实验现象为紫色石蕊试液褪色此实验证明SO2具有漂白性
B. ③中溶液变浑浊是因为SO2和H2S发生了氧化还原反应,氧化产物和还原产物质量比为1∶1
C. ④和②中溶液均褪色,但褪色的原理不同
D. 实验室中可以用澄清石灰水代替氢氧化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com