
����Ŀ�����Ĺ̶��Ǽ���������ѧ��һֱ�о��Ŀ��⡣
��1���±��о��˲�ͬ�¶��´����̵���ҵ�̵��IJ���Kֵ��

�ٷ������ݿ�֪�������̵���Ӧ����_________������ȡ����ȡ�����Ӧ��
�ڷ������ݿ�֪������ʺϴ��ģģ������̵���ԭ��_________��
�۴�ƽ���ӽǿ��ǣ���ҵ�̵�Ӧ��ѡ������������ʵ�ʹ�ҵ����ȴѡ��500�����ҵĸ��£�������ԭ��____________��
��2����ҵ�̵���Ӧ�У�������������ͬʱ���ֱ�ⶨN2��ƽ��ת�����ڲ�ͬѹǿ��p1��p2�������¶ȱ仯�����ߣ���ͼ��ʾ��ͼʾ�У���ȷ����_______���A����B�������Ƚ�p1��p2�Ĵ�С��ϵ________������____________��

��3��20����ĩ����ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+��Ϊ���ʣ�������������������ϵĽ����ٶྦྷ��Ĥ���缫��ʵ�ָ��³�ѹ�µĵ绯ѧ�ϳɰ�������˷�Ӧ���ת���ʣ���ʵ���ͼ��C��ʾ�������ĵ缫��Ӧʽ��___________��
��4�����꣬���п�ѧ������ڳ��¡���ѹ�������������ºϳɰ�������˼·����Ӧԭ��Ϊ��2N2��g��+6H2O��l��![]() 4NH3��g��+3O2��g�������䷴Ӧ�ȡ�H=__________������֪��N2��g��+3H2��g��
4NH3��g��+3O2��g�������䷴Ӧ�ȡ�H=__________������֪��N2��g��+3H2��g��![]() 2NH3��g�� ��H=-92.4kJ��mol-1��2H2��g��+O2��g��
2NH3��g�� ��H=-92.4kJ��mol-1��2H2��g��+O2��g��![]() 2H2O��l�� ��H=-571.6kJ��mol-1��
2H2O��l�� ��H=-571.6kJ��mol-1��
���𰸡� ���� KֵС��������еij̶�С����ת���ʵͣ������ʺϴ��ģ����������������غ��������۷֣������ֵ��ǻ��㲿�֣� ����Ӧ�����Ƕȿ��ǣ����¸��ã����Ӵ������Ե��ۺ����ؿ���ѡ��500�����Һ��ʣ�û�д���������Եģ����۷֣� A p2>p1 ����������ͬʱ����Ӧ��������������������ٵģ�ѹǿ�����ڰ��������ɣ���p2��N2ת���ʸ� N2+6e-+6H+===2NH3 +1530 kJ��mol-1
��������������������⿼���˹���ɵ�Ӧ�ã���ѧƽ�ⳣ����Ӧ�ú�Ӱ�컯ѧƽ�ⳣ�������أ���ѧƽ��ͼ��ķ����������е缫��Ӧʽ����д��
��1���������̵���Ӧ���¶����ߣ���ѧƽ�ⳣ�����������¶�ƽ��������Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ�������̵���Ӧ�������ȷ�Ӧ��
��������˴��ģģ������̵���ԭ���ǣ������̵��Ļ�ѧƽ�ⳣ��С����Ӧ������еij̶�С����Ӧ���ת���ʵ���
����ҵ�̵������¶�Kֵ��С�������¶�ƽ�����淴Ӧ�����ƶ�����ҵ�̵�����ӦΪ���ȷ�Ӧ��ʹ�ó�������߷�Ӧ���ת���ʣ�����Ӧ����С��ʵ�ʹ�ҵ������ѡ��500�����ҵĸ��µ�ԭ���ǣ��ӷ�Ӧ���ʽǶȿ��ǣ����¸�����500��ʱ�����Ļ�����ߡ�
��2����ҵ�̵������¶�Kֵ��С�������¶�ƽ�����淴Ӧ�����ƶ���N2��ת���ʼ�С����ȷ��ͼʾΪA����ͼA�ĺ���������ȡһ����������Ĵ�ֱ���������ཻ����ͼ�ɼ�����ͬ�¶���p2ʱN2��ת���ʴ���p1ʱN2��ת��������ҵ�̵�������Ӧ�������������С�ķ�Ӧ������ѹǿƽ��������Ӧ�����ƶ���N2��ת����������p2![]() p1��
p1��
��3���ϳɰ��ķ�ӦΪN2+3H2![]() 2NH3��N2�����õ��ӵĻ�ԭ��Ӧ��H2����ʧ���ӵ�������Ӧ���������缫��ӦʽΪH2-2e-=2H+�������缫��ӦʽΪN2+6e-+6H+=2NH3��
2NH3��N2�����õ��ӵĻ�ԭ��Ӧ��H2����ʧ���ӵ�������Ӧ���������缫��ӦʽΪH2-2e-=2H+�������缫��ӦʽΪN2+6e-+6H+=2NH3��
��4������Ӧ��ţ�N2��g��+3H2��g��![]() 2NH3��g�� ��H=-92.4kJ��mol-1����ʽ��
2NH3��g�� ��H=-92.4kJ��mol-1����ʽ��
2H2��g��+O2��g��=2H2O��l�� ��H=-571.6kJ��mol-1����ʽ��
Ӧ�ø�˹���ɣ���ʽ![]() 2-��ʽ
2-��ʽ![]() 3��2N2��g��+6H2O��l��
3��2N2��g��+6H2O��l��![]() 4NH3��g��+3O2��g����H=��-92.4kJ/mol��
4NH3��g��+3O2��g����H=��-92.4kJ/mol��![]() 2-��-571.6kJ/mol��
2-��-571.6kJ/mol��![]() 3=+1530kJ/mol��
3=+1530kJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����ͼ�õ�ⷨ���ݵ缫���������ʵ���������֤�����ӵ�����ֵ����ʵ�鷽����Ҫ��Ϊ������ֱ�������Ȼ�ͭ��Һ������������ͼ��
���ڵ���ǿ��ΪI A��ͨ��ʱ��Ϊt s��ȷ�����缫��������ͭ������Ϊm g��
�Իش�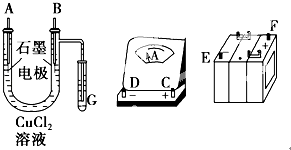
��1��������Щ��������ȷ˳��Ϊ����ͼ�б�ע������������Ӣ����ĸ��ʾ����ͬ����E��D��C�� �� ��F��
��2��д��B���Ϸ�����Ӧ�ĵ缫��Ӧʽ�� �� G�Թ��е���KI��Һ�仯������Ϊ �� ��Ӧ�����ӷ���ʽ�� ��
��3��Ϊ��ȷ�ⶨ�缫������ͭ���������������ʵ�鲽����Ⱥ�˳��Ӧ�� �� �ٳ������ǰ�缫����
�ڹ��µ���缫�ϵ�ͭ����ϴ
��������ˮ��ϴ����缫
�ܵ��º�ɵ缫�����
�ݵ��º�ɹ��µ�ͭ�������
���ٴε��º�ɺ����������
��4����֪���ӵĵ���Ϊ1.6��10��19C�����г������ӵ������ļ������ʽ��NA= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ��ϩ(a)������ϩ(b)\��������(c)�ķ���ʽ��ΪC8H8������˵����ȷ����
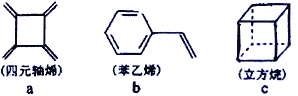
A. a ��ͬ���칹��ֻ��b ��c����
B. a��b��c����ʹ������Ȼ�̼��Һ��ɫ
C. a��b�����е�����ԭ��һ������ͬһƽ��
D. a��c�Ķ��ȴ�����3�֣�b��һ�ȴ�����5 ��(�����������칹)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ˮ��Һ�пɴ��ڵ���ƽ�⣬ˮ��ƽ�⣬�ܽ�ƽ�⣬������ѧ�ش��������⣮
��1�������ʵ���Ũ�ȵ�����������Һ����NH3H2O �ڣ�NH4��2SO3 ��KHSO3 ��K2SO3��Һ��ˮ�ĵ���̶��ɴ�С������˳��Ϊ������ţ���
��2�������ͬ��c��H+����ͬ����������Һ��CH3COOH����HCl����H2SO4�ֱ���ͬŨ�ȵ�NaOH��Һ��ȫ�к�ʱ������NaOH��Һ������ɴ�С������˳����������ţ�����c��H+����ͬ�����������ˮϡ����ԭ����10����c��H+���ɴ�С��˳��Ϊ������ţ���
��3����֪��H+��aq��+OH����aq���TH2O��l����H=��57.3kJ/mol��ʵ����ϡ������ϡNaOH��Һ��Ӧ����1mol H2Oʱ�ų�57kJ���ȣ��������Һ�У����������Ȼ�ѧ����ʽΪ ��
��4��25��ʱ��NH3H2O�ĵ��볣��ΪKb=1.7��10��3 �� 0.1molL��1NH4Cl��Һ��pH=a����c��NH4+����c��NH3H2O��=���ú�a�Ĵ���ʽ��ʾ��
��5��ij��ѧ�о���ѧϰС��Ե������Һ�����¹����ܽᣨ���ڳ����£���������ȷ������pH=1��ǿ����Һ����ˮϡ�ͺ���Һ�и�����Ũ��һ�������͢�pH=2��������pH=13��NaOH��Һ���������9��1��Ϻ����ҺpHΪ11
��pH��ȵ�������Һ��a��CH3COONa��b��NaHCO3��c��NaOH������Һ���ʵ���Ũ����С����˳��Ϊc��b��a
��NH4HSO4��Һ�еμ�NaOH��Һ����ҺpH=7����c��Na+��=2c��SO42����
�������ᣨH3PO3���Ƕ�Ԫ���ᣬ����Na2HPO3ϡ��Һһ���ʼ���
�ס�������Һ����ǿ����ʣ���֪����Һ��pH������ҺpH����������ס�������Һ�������ϣ����ҺpH���ܵ���7��
��ij��Ԫ����ˮ�еĵ��뷽��ʽ��H2B�TH++HB����HB��H++B2�� �� ��0.1mol/L��Na2B��Һ�У�c��Na+��=2c��B2����+2c��HB����
��6��25��ʱKsp[Mg��OH��2]=5.6��10��12 �� Ksp[Cu��OH��2]=2.2��10��20 �� Ksp[Fe��OH��3]=4.0��10��38 �� Ksp[Al��OH��3]=1��.1��10��33 �� ��25���£���Ũ�Ⱦ�Ϊ0.1molL��1��AlCl3��CuCl2�����Һ����μ��백ˮ���������������ѧʽ��������һ��Ũ�ȵ�AlCl3��FeCl3�Ļ����Һ����μ��백ˮ����Fe3+�պ���ȫ����ʱ���ⶨc��Al3+��=0.2molL��1 �� ��ʱ���ó�������������С������С���Al��OH��3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ϵ����һ������Դ������2CO+O 2 �T2CO 2 ���ȼ�ϵ��ʱ������������Ӧ�������� �� ����������Ӧ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ũ�Ⱦ�Ϊ0.1mol/L��100mL��Ba��OH��2��Һ�У��ֱ����Ũ�Ⱦ�Ϊ0.1mol/L��H2SO4��NaHSO4��Һ���䵼�������������Һ����仯����������ͼ��ʾ��
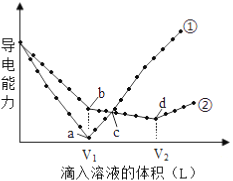
��1�� 0.1mol/L��NaHSO4��ҺpH=_____________��
��2������___________�����μ�H2SO4��Һ�ı仯���ߡ�b����Һ�������Ϊ___________�����Ի���Ի����ԣ���
��3��d����Һ����Ҫ�������ࣺ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳ�ҽ������ҩ��������E��ʳƷ������J��·����ͼ��ʾ��
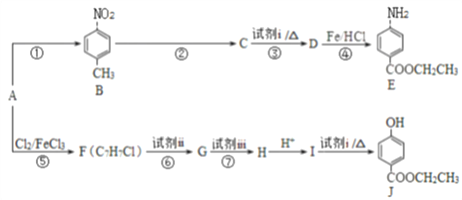
��֪��
��ش��������⣺
��1��A���ڷ��������ṹ��ʽΪ_____________��
��2��E�й����ŵ������ǰ�����____________��
��3��C����NaHCO3��Һ��Ӧ����Ӧ�۵Ļ�ѧ����ʽ��___________��
��4����Ӧ�ޡ������Լ�ii���Լ�iii������ ___________��___________��
��5����Ӧ��~���У�����ȡ����Ӧ����_______________��
��6��J�ж���ͬ���칹�壬���з�������������ͬ���칹����______________�֣�д��������һ��ͬ���칹��Ľṹ��ʽ��___________��
a. Ϊ���Ķ�Ԫȡ�������һ��ȡ����Ϊ�ǻ�
b. �������࣬���ܷ���������Ӧ
��7����AΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳɸ߷�����֬��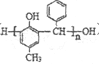 ����д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������_______________��
����д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ���������е�����,�����Լ��ͷ�����ȷ���ǣ� ��
ѡ�� | ���� | ���� | �����������Լ��ͷ��� |
A | KCl��Һ | I2 | ���� |
B | KNO3 | K2SO4 | BaCl2��Һ������ |
C | Cu | CuO | ϡ���ᣬ���� |
D | CaCO3 | Ca(OH)2 | ���ᣬ���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ﺣ���к�������ḻ���ṹ��ӱ�Ĵ�����л����Ǻ��������������ʵ���Ҫ��Դ֮һ��һ�ִӺ�������ȡ���п��������Ե���Ȼ������������£�
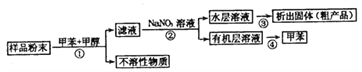
���й��ڸ������и������˵���У�������ǣ� ��
ѡ�� | ���� | ����װ�� | ��Ҫ���� |
A | �� | ����װ�� | ©�� |
B | �� | ��Һװ�� | ��Һ©�� |
C | �� | ����װ�� | ���� |
D | �� | ����װ�� | ������ƿ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com