
【题目】某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:①用直流电电解氯化铜溶液,所用仪器如图.
②在电流强度为I A,通电时间为t s后,精确测得其电极上析出的铜的质量为m g.
试回答: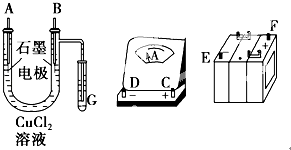
(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示,下同):E接D,C接 , 接F.
(2)写出B极上发生反应的电极反应式: , G试管中淀粉KI溶液变化的现象为 , 相应的离子方程式是 .
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是 . ①称量电解前电极质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜,后称量
⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10﹣19C.试列出阿伏加德罗常数的计算表达式:NA= .
【答案】
(1)A;B
(2)2Cl﹣﹣2e﹣═Cl2↑;变蓝色;Cl2+2I﹣═I2+2Cl﹣
(3)①③④⑥
(4)![]()
【解析】解:(1)依据装置图分析可知U形管通入G中的气体是氯气,所以B电极为阳极,A为阴极,电路连接应遵循电流计串联,电源负极接电流表负极,电流表的正极接U形管A电极,B电极接电源的正极;所以线路连接顺序是E﹣D﹣C﹣A﹣B﹣F;所以答案是:A、B;(2)B为电解池中阳极,溶液中的氯离子失电子发生氧化反应生成氯气,电极反应为:2Cl﹣﹣2e﹣═Cl2↑,G试管中是通入的氯气,氯气和电化甲反应生成碘单质,遇到淀粉变蓝,反应的离子方程式为:Cl2+2I﹣═I2+2Cl﹣;所以答案是:2Cl﹣﹣2e﹣═Cl2↑,变蓝色,Cl2+2I﹣═I2+2Cl﹣;(3)根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量,则需要称量电解前后电极的质量,实验之前应称量电解前电极的质量,电解后,电极在烘干称重前,必须用蒸馏水冲洗,减少误差,电极在烘干称重的操作中必须按“烘干﹣称重﹣再烘干﹣再称重”进行,防止Cu被氧化,在有空气存在的情况下,烘干电极必须采用低温烘干的方法,防止Cu被氧化,为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是:①称量电解前电极质量,实验之前应称量电解前电极的质量;③用蒸馏水清洗电解后电极;④低温烘干电极后称量;⑥再次低温烘干后称量至恒重;其中②刮下电解后电极上的铜并清洗,⑤低温烘干刮下的铜,后称量;步骤中刮下称量会产生较大的误差,所以步骤中不选择;所以答案是:①③④⑥;(4)依据电荷守恒得到,It= ![]() ,所以NA=
,所以NA= ![]() ;所以答案是:
;所以答案是: ![]() ;
;


科目:高中化学 来源: 题型:
【题目】防治环境污染,改善生态环境已成为全球的共识.①空气质量报告的各项指标可以反映出各地空气的质量.下列气体已纳入我国空气质量报告的是
(填字母). a.CO2 b.N2 c.NO2
②垃圾应分类收集.导致“白色污染”的生活垃圾应放置于贴有(填字母)标志的垃圾筒内.
③工业废水需处理达标后才能排放.下列废水处理的方法合理的是(填字母).
a.用中和法除去废水中的酸 b.用混凝剂除去废水中的重金属离子
c.用氯气除去废水中的悬浮物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砹是原子序数最大的卤族元素,推测砹或砹的化合物最可能具有的性质是
①砹化氢很稳定②砹单质与水反应,使砹全部转化成氢砹酸和次砹酸③砹是黑色固体 ④砹化银难溶于水⑤砹易溶于某些有机溶剂
A. ①③④⑤ B. ③④⑤ C. 只有③⑤ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3。实验员选择了一种试剂就把它们区别开来了,这种试剂是( )
A. 盐酸 B. 氢氧化钠溶液 C. 氯化钡溶液 D. 硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)中国古代四大发明之一﹣﹣黑火药,它的爆炸反应为:2KNO3+3C+S ![]() A+N2↑+3CO2↑(已配平) ①除S外,上述元素的电负性从大到小依次为;
A+N2↑+3CO2↑(已配平) ①除S外,上述元素的电负性从大到小依次为;
②在生成物中,含极性共价键的分子的中心原子轨道杂化类型为 , A的晶体类型为 .
③已知CN﹣与N2结构相似,推算HCN分子中σ键与π键数目之比为 .
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2;T的基态原子外围电子(价电子)排布为 , Q2+的未成对电子数是 .
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6﹣n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R﹣H),可发生离子交换反应:[CrCln(H2O)6﹣n]x++xR﹣H→Rx[CrCln(H2O)6﹣n]+xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成.将含0.0015mol[CrCln(H2O)6﹣n]x+的溶液,与R﹣H完全交换后,中和生成的H+需浓度为0.1200molL﹣1NaOH溶液25.00mL,可知该配离子的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是(NA为阿伏伽德罗常数):
A.H2的摩尔质量为2g
B.1mol/LNa2CO3溶液中含有Na+数目为NA
C.标况下,0.5mol CO2的体积为11.2L
D.1mol H2O含有8mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的一半。下列说法正确的是( )
A. 原子半径:W>Z>Y>X>M
B. 将XZ2通入W单质与水反应后的溶液中,一定只生成一种盐
C. 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键
D. CaX2、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。

①分析数据可知:大气固氮反应属于_________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因_________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因____________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下图所示的图示中,正确的是_______(填“A”或“B”);比较p1、p2的大小关系________,理由____________。

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是___________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g),则其反应热△H=__________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H=__________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1,2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1,2H2(g)+O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1)
2H2O(l) △H=-571.6kJ·mol-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com