
【题目】下列物质中,既有离子键又有共价键的是
A.CaCl2B.NH4Cl
C.H2OD.HF
科目:高中化学 来源: 题型:
【题目】下列化学用语或物质的性质描述正确的是( )
A.右图的键线式表示烃的名称为:3﹣甲基﹣4﹣乙基﹣7﹣甲基辛烷 
B.符合分子式为C3H8O的醇有三种不同的结构
C.![]() 中,所有原子不可能都在同一平面上
中,所有原子不可能都在同一平面上
D.治疗疟疾的青蒿素(如图)  ,分子式是C15H20O5
,分子式是C15H20O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=3的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。下列说法不正确的是

A. 曲线I代表盐酸的稀释过程
B. a溶液的导电性比b溶液的导电性强
C. b溶液中和氢氧化钠的能力强于a溶液
D. 将a、b两溶液加热至30℃, 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法中正确的是( )
A. 由上述信息可推知河虾中的砷被还原
B. 因为河虾中含有砷元素,所以不能食用
C. 上述反应中维生素C作氧化剂
D. 在该反应中维生素C作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol/L、100mL的Ba(OH)2溶液中,分别滴入浓度均为0.1mol/L的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。
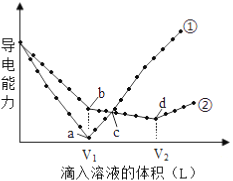
(1) 0.1mol/L的NaHSO4溶液pH=_____________。
(2)曲线___________代表滴加H2SO4溶液的变化曲线。b点溶液的酸碱性为___________(酸性或碱性或中性)。
(3)d点溶液中主要离子种类:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是( )
A. 50mL 0.5mol/L MgCl2溶液 B. 200mL 0.25mol/L AlCl3溶液
C. 100mL 0.5mol/L NaClO3溶液 D. 25mL 0.5mol/L HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0L恒容密闭容器中充入2mol SO2和1mol O2 , 发生反应: 2SO2(g)+O2(g)2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前t1 s 的平均速率v(O2)= ![]() ?mol?L﹣1?s﹣1
?mol?L﹣1?s﹣1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.相同温度下,起始时向容器中充入4mol SO3 , 达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2mol SO2、1mol O2 , 反应达到新平衡时 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,用化学用语回答下列问题:
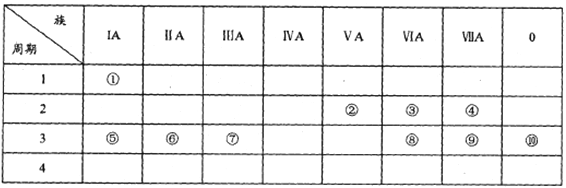
(1)请画出元素⑨阴离子的结构示意图:________。
(2)③⑤⑧的原子半径由小到大的顺序为________(填元素符号)。
(3)⑤和⑦的最高价氧化物对应水化物的碱性强弱为_____>____(填化学式)。
(4)③⑤两种元素的原子按1:1组成的常见化合物的电子式为_______。
(5)用电子式表示⑥和⑨形成的化合物的过程:_________。
II.由表中①~⑩中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),请回答下列问题:
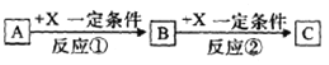
(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,检验此C溶液中金属离子的方法是_______;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式:___________。
(2)若A、B、C为含有同一金属元素的无机化合物,X为强碱,A溶液与C溶液反应生成B,则B的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X~W是元素周期表中的短周期元素,其性质或结构信息如下表:
元素 | X | Y | Z | V | W |
性质信息 | 单质为有色气体,有毒,可用于自来水消毒 | 日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 | 其单质在空气中约占4/5左右 | 单质为淡黄色晶体,质脆,不溶于水,微溶于酒精 | 位于第ⅣA,是形成的化合物最多的元素之一 |
回答下列问题:
(1)X在元素周期表中的位置是____________,V2-离子结构示意图为______________。
(2)Z的单质特别稳定,原因在于_______________;X、Y和V三元素中原子半径最小的是_________。
(3)WV2常温下呈液态,是一种常见的溶剂。已知WV2在氧气中完全燃烧,生成VO2和WO2,若0.1 mol WV2在1 mol O2中完全燃烧,则所得气体混合物在标准状况下的体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com