
【题目】Ⅰ.电化学原理在化学工业中有广泛应用。下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:

(1)M极的电极材料是___.甲池中溶液的pH值___(填“增大”、“不变”或“减小”)加入乙醇的铂电极的电极反应式为______.
(2)若在常温常压下,2g乙醇燃烧生成CO2液态H2O时放出59kJ热量,表示该反应的热化学方程式______.
Ⅱ.熔融碳酸盐燃料电池(MCFS),发明于1889年.现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示.

请回答下列问题:
(1)A极为___极,电极的电极反应方程式为______.
(2)若两个电极均为惰性电极,以此电源电解足量的CuSO4溶液.电解一段时间后,阳极上产生气体的体积为0.224L(标准状况下),则阴极上析出的金属的质量为_____g。若电解后溶液的体积为0.4L,溶液的pH约为______.
【答案】阴极减小C2H5OH12e+16OH=2CO32+11H2OC2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H=-1357kJ/mol负CO+H2-4e-+2CO32-=3CO2+H2O1.281
【解析】
Ⅰ.碱性乙醇电池为原电池,通入乙醇的电极是负极,通入氧气的电极是正极,乙池有外接电源,属于电解池,根据图片知,N是阳极,M是阴极,工作时M、N两个电极的质量都不减少,则M电极是铁,N电极是石墨;据以上分析解答。
Ⅱ. CO和H2燃料电池,CO和H2在负极发生氧化反应;用该电源电解硫酸铜溶液,总反应为2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑,据此进行相关的计算。
2Cu+2H2SO4+O2↑,据此进行相关的计算。
Ⅰ.碱性乙醇电池为原电池,通入乙醇的电极是负极,通入氧气的电极是正极,乙池有外接电源,属于电解池,根据图片知,N是阳极,M是阴极,工作时M、N两个电极的质量都不减少,则M电极是铁,N电极是石墨,
(1)通过以上分析知,M是阴极,N极是阳极, 甲池中电解总反应:2CH3OH+3O2+4KOH=2K2CO3+6H2O,氢氧化钾被消耗,碱性减弱,甲池中溶液的pH值减小;乙醇的铂电极附近发生氧化反应,乙醇被氧化为二氧化碳,在碱性环境中生成碳酸根离子,极反应为:C2H5OH12e+16OH=2CO32+11H2O;综上所述,本题答案是:阴极;减小;C2H5OH12e+16OH=2CO32+11H2O。
(2)若在常温常压下,2g乙醇燃烧生成CO2液态H2O时放出59kJ热量,则46 g乙醇燃烧生成CO2液态H2O时放出热量1357kJ;反应的热化学方程式:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l)△H=-1357kJ/mol;综上所述,本题答案是:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l)△H=-1357kJ/mol。
Ⅱ.(1)该燃料电池中,负极的气体按物质的量之比为1:1参与反应, A极为负极,则负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为: CO+H2-4e-+2CO32-=3CO2+H2O;综上所述,本题答案是:负;CO+H2-4e-+2CO32-=3CO2+H2O。
(2)电解硫酸铜的总反应为:2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑,阳极上产生氧气的体积为0.224L,物质的量为0.01mol,根据反应关系可知,阴极析出的金属铜的质量为0.01× 2×64=1.28g;因电解后溶液为硫酸,其物质的量为0.01×2=0.02mol,溶液中氢离子浓度为0.02×2/0.4=0.1mol/L,溶液的pH为1;综上所述,本题答案是:1.28,1。
2Cu+2H2SO4+O2↑,阳极上产生氧气的体积为0.224L,物质的量为0.01mol,根据反应关系可知,阴极析出的金属铜的质量为0.01× 2×64=1.28g;因电解后溶液为硫酸,其物质的量为0.01×2=0.02mol,溶液中氢离子浓度为0.02×2/0.4=0.1mol/L,溶液的pH为1;综上所述,本题答案是:1.28,1。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述错误的是( )
A. 常温常压下,3.6 g H2O中所含电子数为2NA
B. 1 mol NH4HCO3晶体中,含有NH4+、NH3和NH3·H2O的总数为NA
C. 标准状况下,22.4LO2和22.4LNO混合后所得气体分子数小于1.5NA
D. 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO- 数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能光伏电池可通过并网,使用半导体照明(LED);已知发出白光的LED是由GaN芯片和钇铝石榴石(Y3Al5O12)芯片封装在一起做成的。下列有关叙述正确的是
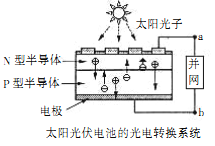
A. 光伏电池实现了太阳能和电能的相互转化
B. 图中N型半导体为正极,P型半导体为负极
C. LED是新型有机高分子材料
D. LED中的Ga和Y都显+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存方法错误的是( )
A.实验室少量的钠保存在煤油中B.浓硝酸保存在无色细口玻璃瓶中
C.存放FeSO4溶液时加入少量铁粉D.NaOH溶液保存在橡皮塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】click“点击化学”是一种绿色、高效的有机合成手段。其中铜(Ⅰ)催化的炔-叠氮基的点击反应获得五元杂环三氮唑在医药领域有广泛的用途。由芳香化合物A合成G的过程如下:

已知:a.tBu代表叔丁基![]()
b. 
(1)A的名称为___________,下列关于A的说法正确的是___________ (填字母)。
a属于芳香烃 b.遇FeCl3溶液显紫色
c苯环上的一溴代物有两种 d不能发生氧化反应
(2)B的结构简式为___________,其分子中最多有___________个原子共平面。
(3)化合物F到G的反应类型为_________________________________。
(4)书写化合物D到E化学方程式_________________________________。
(5)D的一种同分异构体H能与碳酸氢钠反应,且核磁共振氢谱峰面积比为6︰1,H的结构简式为________。
(6)索烃是一种类似锁链没有化学键连接的多个环状分子组合休。“click”反应广泛用于合成类索烃的基本单元。以![]() 为原料,仿照流程中“click”反应,书写合成环状分子
为原料,仿照流程中“click”反应,书写合成环状分子 的路线,有机试剂和无机试剂任选。________________
的路线,有机试剂和无机试剂任选。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。下表为8种元素在周期表中的位置。

(1)下图所示的模型表示的分子中,可由A、D形成的是________。


写出c分子的空间构型为_________,d分子的结构简式 _________。
(2)关于d分子有下列问题:
①d分子中同一平面的原子最多有_______个。
②若用-C4H9取代环上的一个H原子,得到的有机物的同分异构体共有__________种。
(3)Na在F单质中燃烧产物的电子式为______。上述元素的最高价氧化物的水化物中,碱性最强的是______ (写化学式) ,其与Q的单质反应的离子方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】斯坦福大学的研究人员提出的一种基于CH3OH的碳循环(如图所示),下列说法正确的是

A. 图中能量转化方式只有2种
B. CO2、CH3OH均属于有机化合物
C. 制取CH3OH反应:CO2+3H2![]() CH3OH+H2O的原子利用率为100%
CH3OH+H2O的原子利用率为100%
D. 利用CO2合成CH3OH燃料有利于减少对化石能源的依赖并减少碳排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氧化铋在汽车装饰,电子设备等生活方面有广泛的应用。利用铜转炉烟尘(主要为含铋的化合物,另外还含Cu、Pb、Bi的硫酸盐及CuS、Fe2O3)可生产氯氧化铋,其工艺流程如下:

(1)提高“酸浸”反应速率的措施有适当增加硫酸的浓度和_____________。
(2) “浸渣1”中除铋的化合物外,还有的物质是_______________(填化学式)
(3) “浸液1”中加入过量锌粉,作用是____________________;反应完毕后,过滤,从滤液中得到ZnSO4·7H2O晶体的操作有________、________、过滤、洗涤、干燥。
(4)“浸铜”时,有单质硫生成,写出生成硫的离子方程式________________________
(5)“浸铋”时,在室温和液固比(盐酸、NaCl溶液组成的混合溶液的质量与“浸渣2”的质量的比值)固定的条件下,c(HCl)=1 mol·L-1时,铋的浸出率和Cl-浓度的关系如下图所示,其中NaCl的作用是_________,若升高温度,铋的浸出率反而下降,其可能的原因是__________________________________。

(6)“沉铋”时需要控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1
②C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=-Q3 kJ·mol-1
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)
A. Q1+Q2+Q3B. 1.5Q1-0.5Q2+0.5Q3
C. 0.5Q1-1.5Q2+0.5Q3D. 0.5(Q1+Q2+Q3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com