
【题目】已知:①H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1
②C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=-Q3 kJ·mol-1
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)
A. Q1+Q2+Q3B. 1.5Q1-0.5Q2+0.5Q3
C. 0.5Q1-1.5Q2+0.5Q3D. 0.5(Q1+Q2+Q3)
科目:高中化学 来源: 题型:
【题目】Ⅰ.电化学原理在化学工业中有广泛应用。下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:

(1)M极的电极材料是___.甲池中溶液的pH值___(填“增大”、“不变”或“减小”)加入乙醇的铂电极的电极反应式为______.
(2)若在常温常压下,2g乙醇燃烧生成CO2液态H2O时放出59kJ热量,表示该反应的热化学方程式______.
Ⅱ.熔融碳酸盐燃料电池(MCFS),发明于1889年.现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示.

请回答下列问题:
(1)A极为___极,电极的电极反应方程式为______.
(2)若两个电极均为惰性电极,以此电源电解足量的CuSO4溶液.电解一段时间后,阳极上产生气体的体积为0.224L(标准状况下),则阴极上析出的金属的质量为_____g。若电解后溶液的体积为0.4L,溶液的pH约为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质进行的分类正确的是( )
A.纯碱、烧碱均属于碱B.CuSO4·5H2O、液氨均属于纯净物
C.凡能电离出H+的化合物均属于酸D.NaCl H2SO4 BaSO4 NH3 均属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质。工业冶炼铜的化学方程式是:8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和____________。
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验。
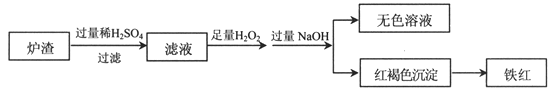
①滤液中的阳离子有Fe3+、Fe2+、H+、_____________。
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是____(填序号)。
实验方案 | 预期现象 | |
a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
c | 加酸性KMnO4溶液 | 紫色褪去 |
d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
③滤液在酸性条件下,与H2O2反应的离子方程式是_________________________。
(3)m克铝热剂(氧化铁与铝)恰好完全反应,则该反应中氧化产物与还原产物的质量比是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的反应:X(s)+3Y(g)![]() 2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有氯化钡稀溶液的甲、乙两试管中分别通入SO2至饱和,若继续向甲试管中加入足量H2O2溶液,向乙试管中加入足量氢氧化钾溶液,则下列叙述正确的是( )
A.甲、乙两试管中都有白色沉淀生成
B.甲、乙两试管中都没有白色沉淀生成
C.甲试管中没有白色沉淀生成而乙试管中有
D.甲试管中有白色沉淀生成而乙试管中没有
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
D | 胆矾 | 食盐水 | 氯化铜 | 碳酸钠 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag2SO4微溶于水,可溶于硝酸。溶液X中可能含有Na+、Ca2+、Fe2+、Cl-、Br-、CO![]() 、SiO
、SiO![]() 、SO
、SO![]() 中的几种离子。为了确定其组成,某同学进行了如下实验:
中的几种离子。为了确定其组成,某同学进行了如下实验:

下列说法正确的是( )
A. 溶液X中一定含有Na+、Cl-和SiO![]()
B. 溶液X中一定不含Ca2+、Br-
C. 为确定溶液X中是否含有SO![]() ,可取溶液2,加入BaCl2溶液
,可取溶液2,加入BaCl2溶液
D. 在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变成血红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com