
【题目】有一处于平衡状态的反应:X(s)+3Y(g)![]() 2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
【答案】D
【解析】试题分析:反应X(s)+3Y(g)![]() 2Z(g),△H<0,正反应是气体物质的量减小的放热反应,①升高温度,平衡逆向移动,故①错误;②降低温度,平衡向正反应移动,故②正确;③压强增大,平衡向正反应移动,故③正确;④降低压强,平衡向逆反应方向移动,故④错误;⑤加催化剂缩短到达平衡的时间,不会引起化学平衡的移动,故⑤错误;⑥分离出Z,即减小生成物的浓度,平衡正向移动,故⑥正确;故选C。
2Z(g),△H<0,正反应是气体物质的量减小的放热反应,①升高温度,平衡逆向移动,故①错误;②降低温度,平衡向正反应移动,故②正确;③压强增大,平衡向正反应移动,故③正确;④降低压强,平衡向逆反应方向移动,故④错误;⑤加催化剂缩短到达平衡的时间,不会引起化学平衡的移动,故⑤错误;⑥分离出Z,即减小生成物的浓度,平衡正向移动,故⑥正确;故选C。
【名师点晴】本题考查化学平衡移动的影响因素等。升高温度,平衡向吸热反应移动;降低温度,平衡向放热反应移动;压强增大,平衡向气体体积减小的方向移动;降低压强,平衡向气体体积增大的方向移动;加催化剂不会引起化学平衡的移动;增大反应物浓度或减小生成物的浓度,平衡正向移动;减小反应物浓度或增大生成物浓度,平衡逆向移动。注意加入惰性气体对平衡的影响,恒温恒容平衡不移动,恒温恒压,体积增大,平衡向体积增大方向移动。


科目:高中化学 来源: 题型:
【题目】click“点击化学”是一种绿色、高效的有机合成手段。其中铜(Ⅰ)催化的炔-叠氮基的点击反应获得五元杂环三氮唑在医药领域有广泛的用途。由芳香化合物A合成G的过程如下:

已知:a.tBu代表叔丁基![]()
b. 
(1)A的名称为___________,下列关于A的说法正确的是___________ (填字母)。
a属于芳香烃 b.遇FeCl3溶液显紫色
c苯环上的一溴代物有两种 d不能发生氧化反应
(2)B的结构简式为___________,其分子中最多有___________个原子共平面。
(3)化合物F到G的反应类型为_________________________________。
(4)书写化合物D到E化学方程式_________________________________。
(5)D的一种同分异构体H能与碳酸氢钠反应,且核磁共振氢谱峰面积比为6︰1,H的结构简式为________。
(6)索烃是一种类似锁链没有化学键连接的多个环状分子组合休。“click”反应广泛用于合成类索烃的基本单元。以![]() 为原料,仿照流程中“click”反应,书写合成环状分子
为原料,仿照流程中“click”反应,书写合成环状分子 的路线,有机试剂和无机试剂任选。________________
的路线,有机试剂和无机试剂任选。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向300 mL 1 mol·L-1的稀硝酸中,加入5.6 g铁粉,充分反应后,铁粉全部溶解(假设还原产物只有NO),下列说法不正确的是( )
A. 最终所得溶液中既有Fe2+又有Fe3+
B. 最终溶液中,硝酸无剩余
C. 标准状况下生成NO的体积为1.68 L
D. 再向最终所得溶液中滴加稀硝酸,无明显变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.硫是一种能溶于水的黄色晶体
B.在自然界中既有化合态的硫,又有游离态的硫
C.硫与铁反应生成硫化亚铁
D.硫在空气中的燃烧产物是二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(gL-1)如图所示。已知盐酸浓度大于1molL-1时,发生反应:PbCl2(s)+2Cl-(aq)═PbCl42-(aq)。下列叙述正确的是
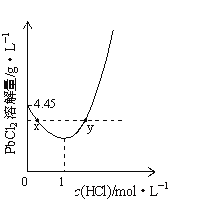
A. 盐酸浓度越小,Ksp(PbCl2)越小
B. x、y两点对应的溶液中c(Pb2+)相等
C. 当盐酸浓度为1molL-1时,溶液中c(Pb2+)一定最小
D. 当盐酸浓度小于1molL-1时,随HCl浓度增大,PbCl2溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1
②C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=-Q3 kJ·mol-1
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)
A. Q1+Q2+Q3B. 1.5Q1-0.5Q2+0.5Q3
C. 0.5Q1-1.5Q2+0.5Q3D. 0.5(Q1+Q2+Q3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.5mol·L-1的盐酸与50mL 0.55mol·L-1的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________________。由图可知该装置仍有不妥之处,如不改正,求得的中和热数值会____________(填“偏大”“偏小”“无影响”)。
(2)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):_______________。
(3)取50 mL NaOH溶液和50mL盐酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.1 | ________________ |
2 | 25.9 | 25.9 | 25.9 | 29 | |
3 | 27.0 | 27.4 | 27.2 | 31.7 | |
4 | 26.4 | 26.2 | 26.3 | 29.2 | |
②近似认为0.55 mol·L-1 NaOH溶液和0.50 mol·L-1盐酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH=________(取小数点后一位)。
(4)下列情况会使测得中和热的数值偏小的是________(填字母)。
A.用浓硫酸代替盐酸进行上述实验
B. 用相同浓度和体积的氨水代替NaOH溶液进行上述实验
C. 用50mL 0.50 mol·L-1的 NaOH溶液进行上述实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的Na2CO3溶液,下列操作正确的是
A. 称量时,将Na2CO3固体直接放在托盘天平的右盘上
B. 将Na2CO3固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中
C. 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D. 定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B. 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C. 反应至6 min时,c(H2O2)=0.3 mol/L
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com