
�������C11H12O3�����Ʊ�Һ�����ϵ��м���֮һ��������к���ȩ�����������������E��H��һ�������ºϳɣ�

��֪������Ϣ��
1��A�ĺ˴Ź������ױ�����ֻ��һ�ֻ�ѧ�������⣻
2��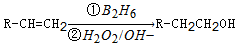
3��������F�����ϵ�һ�ȴ���ֻ�����֣�
4��ͨ����ͬһ��̼ԭ�������������ǻ����ȶ�������ˮ�γ��ʻ���
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ_________��
��2��D�Ľṹ��ʽΪ_________��
��3��E�ķ���ʽΪ___________��
��4��F����G�Ļ�ѧ����ʽΪ________,�÷�Ӧ����Ϊ__________��
��5��I�Ľṹ��ʽΪ___________��
��6��I��ͬϵ��J��I��Է�������С14��J��ͬ���칹������ͬʱ��������������
�ٱ�����ֻ������ȡ�������ڼ��ܷ���������Ӧ�����ܺͱ���NaHCO3��Һ��Ӧ�ų�CO2������______�֣������������칹����J��һ��ͬ���칹�巢��������Ӧ���ữ��˴Ź�������Ϊ����壬�ҷ������Ϊ2��2��1��д��J������ͬ���칹��Ľṹ��ʽ______��
��1��2-��-2-�ȱ��飨���嶡���ȣ�
��2��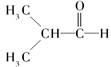
��3��C4H8O2
��4�� 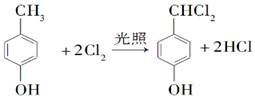 ȡ����Ӧ
ȡ����Ӧ
��5��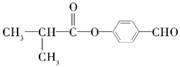
��6��18 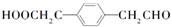
����������1��A�ķ���ʽΪC4H9Cl���˴Ź������ױ�����ֻ��һ�ֻ�ѧ�������⣬����A�Ľṹ��ʽΪ(CH3)3CCl��Ϊ2-��-2-�ȱ��飻
��2��A��B����ȥ��Ӧ��B��(CH3)2C=CH2��B��C�Ǽӳɷ�Ӧ�������ṩ�ķ�Ӧ��Ϣ��C��(CH3)2CHCH2OH��C��D��������Ӧ��D��(CH3)2CHCHO��
��3��D��E��������Ӧ��E��(CH3)2CHCOOH������ʽΪC4H8O2��
��4��F�ķ���ʽΪC7H8O�������ϵ�һ�ȴ���ֻ�����֣�����F�Ľṹ��ʽΪ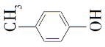 ���ڹ��������������������ʵ���֮��1��2��Ӧ���ǶԼ��еļ��е�2��H��Clȡ������ѧ����ʽΪ��
���ڹ��������������������ʵ���֮��1��2��Ӧ���ǶԼ��еļ��е�2��H��Clȡ������ѧ����ʽΪ��
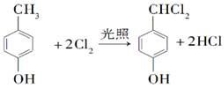 ������ȡ����Ӧ��
������ȡ����Ӧ��
��5��F��G��ȡ����Ӧ��G��H��ˮ�ⷴӦ��������Ϣ��Ӧ���ǡ�CHCl2��ɡ�CHO��H��I��������Ӧ��I�Ľṹ��ʽΪ
��6��J��I��ͬϵ���Է�������С14��˵��J��I��һ��Cԭ�ӣ�����ȡ���������ܷ���������Ӧ�����ܺͱ���NaHCO3��Һ��Ӧ�ų�CO2��������һ�����Ȼ���һ��ȩ������COOH�롪CH2CH2CHO��ϣ���COOH�롪CH(CH3)CHO��ϣ���CH2COOH�롪CH2CHO��ϣ���CH2CH2COOH�롪CHO��ϣ���CH(CH3)COOH�롪CHO��ϣ���HOOCCH��CHO�����롪CH3����ϣ�ÿһ����Ͽ����ڡ��䡢������λ�ñ仯��һ����6��3=18������������ͬ���칹�塣���У�һ��ͬ���칹�巢��������Ӧ���ữ��˴Ź�������Ϊ����壬�ҷ������Ϊ2��2��1���ṹ��ʽΪ��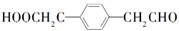


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��5 ���ͣ������
ʵ������ȡ���ᶡ����ʵ��װ����������ͼ��ʾ����װ�ù�ѡ�á����й����ʵ���������

���±���
| ���� | 1-���� | ���ᶡ�� |
�۵�(��) | 16.6 | ��89.5 | ��73.5 |
�е�(��) | 117.9 | 117 | 126.3 |
�ܶ�(g/cm3) | 1.05 | 0.81 | 0.88 |
ˮ���� | ���� | ����(9g/100gˮ) | �� |
��1����ȡ���ᶡ����װ��Ӧѡ��_______(��ס����ҡ�)����ѡ��һ��װ�õ������� ��
��2����ʵ���������г������������ᶡ���⣬���������ɵ��л��������У�д���ṹ��ʽ���� �� ��
��3��������Ӧ��һ�����淴Ӧ��Ϊ���1-������ �����ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
�����ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
��4�����Ʊ����ᶡ�����õĻ�����з��롢�ᴿ���ᶡ��ʱ����Ҫ�����ಽ����������ͼʾ�IJ����У��϶���Ҫ�Ļ�ѧ������___________��ѡ��𰸱�ţ���
��5���л���ķ�������У�������Ҫʹ�÷�Һ©����������ʹ�÷�Һ©��ǰ���� ��ijͬѧ�ڽ��з�Һ����ʱ��������Һ�����������������ԭ�����Һ©�����������⣬������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��3 ���ͣ�������
����ʯ����ѧʽ��ʾΪMgCO3��CaCO3��Ϊԭ���Ʊ�Mg(OH)2�Ĺ�����������ͼ��ʾ��
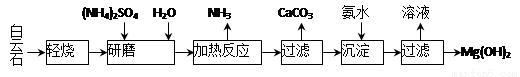
��1����ĥ�������� ��
��2���ù����п�ѭ��ʹ�õ������� �� ��д��ѧʽ����
��3������ʯ���յ���Ҫ������MgO��CaCO3������ͳ�����ǽ�����ʯ���ȷֽ�ΪMgO��CaO����ȡ������ʯ���յ��ŵ��� ��
��4�����ȷ�Ӧ�����ӷ���ʽΪ ��
��5���ټ��ȷ�Ӧʱ����323k��353k��Һ��c(NH4+)�뷴Ӧʱ��Ĺ�ϵ����ͼ��ʾ��������ͼ����373k�����ߡ�
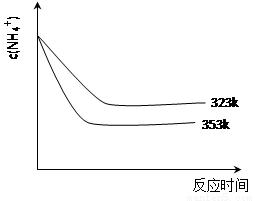
����ͼ��֪�������¶����ߣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��2 ���ͣ������
̼��̼�Ļ�����㷺�Ĵ� �������ǵ������С�
�������ǵ������С�
��1���������з�Ӧ�������仯ʾ��ͼ��2C(s)+O2(g) =2CO(g) ��H= ��
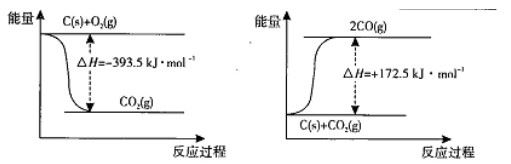

��2�������Ϊ2L���ܱ������У�����1 mol CO2��3mol H2��һ��
�����·�����Ӧ��
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H
CH3OH(g)+H2O(g) ��H
���CO2(g)��CH3OH(g)�����ʵ�����ʱ��仯����������ͼ��ʾ:
�ٴӷ�Ӧ��ʼ��ƽ�⣬H2O��ƽ����Ӧ����v(H2O)= ��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����� �����ţ���
A�������¶� B����CH3OH��g����ʱҺ���Ƴ�
C��ѡ���Ч���� D���ٳ���l mol CO2��4 mol H2
��3�� CO2����ˮ����̼�ᡣ��֪�������ݣ�
������� | H2CO3 | NH3��H2O |
����ƽ�ⳣ���� 25�棩 | Ka1= Ka2= 5��61�� 10һ11 | Kb = 1��77�� 10һ5 |
���г�����1 mol��L��1��( NH4)2CO3��Һ����֪��NH4+ˮ���ƽ�ⳣ��Kh=Kw/Kb��
CO32-��һ��ˮ���ƽ�ⳣ��Kh=Kw/Ka2��
���жϸ���Һ�� ����ᡱ�����С��� ������ԣ�д������Һ��CO32-
������һ��ˮ������ӷ���ʽ ��
����������֮��Ĺ�ϵʽ��������ȷ���� ��
A��c(NH4+)��c(HCO3-)�� c(CO32-)��(NH4+)
B��c(NH4+)+c(H+)= c(HCO3-)+c(OH-)+ c(CO32-)
C. c(CO32-)+ c(HCO3-)+c(H2CO3)=1mol/L
D. c(NH4+)+ c(NH3.H2O)=2 c(CO32-)+ 2c(HCO3-) +2c(H2CO3)
��4���ݱ�������ѧ����ʵ���������Ƴ���ȼ�ϵ�صķ�Ӧ�����У�������
��缫������CO��O2Ϊԭ�����ɵ�ء�ԭ����ͼ��ʾ��ͨ��CO�Ĺܿ��� ���c����d������д���õ缫�ĵ缫��Ӧʽ�� ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��2 ���ͣ�ѡ����
������ˮ�����״�л���C4H6O2������˵����ȷ����
A�������ʲ���ʹ���CC14��Һ��ɫ B��������һ�����ܷ���ȡ����Ӧ
C�������ʿ��ܵĽṹ����5�� D����������C2H4O2���ܻ�Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��17 ���ͣ�ѡ����
�����£����и���������ָ����Һ��һ���ܴ����������
A��1.0 mol��L��1 KNO3��Һ��H����Fe2����SCN����SO42-
B��c(H��)/c(OH��)��10��10����Һ��K����Ba2���� NO3-��Cl��
C��pH��0����Һ��Al3����Ag(NH3)2+��Cl����SO42-
D��c(ClO��)��1.0 mol��L��1����Һ��Na����SO32-��S2����SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��17 ���ͣ�ѡ����
Cu��Cu2O��CuO��ɵĻ�������100 mL 0.6 mol/L HNO3��Һ��ǡ��ʹ������ܽ⣬ͬʱ�ռ���224 mL NO����(��״��)������˵������ȷ����
A������������ͭ�����ʵ���Ϊ0.025 mol
B�����������Cu�����ʵ���Ϊ0.005 mol��������Cu2O��CuO�����ʵ�����0.020 mol
C����������к�0.01 mol Cu��������Cu2O��CuO�����ʵ�����Ϊ0.005 mol
D���������Cu�����ʵ�����ȡֵ��ΧΪ0.005 mol<n(Cu)<0.015 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��16 ���ͣ�ѡ����
ij�¶�ʱ�����ܱ�������X��Y��Z��������Ũ�ȵı仯��ͼ����ʾ���������������䣬���¶ȷֱ�ΪT1��T2ʱ��Y�����������ʱ���ϵ��ͼ����ʾ�������н�����ȷ����
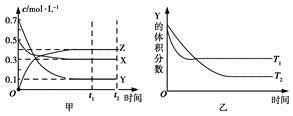
A���÷�Ӧ���Ȼ�ѧ����ʽΪX(g)��3Y(g)  2Z(g)����H>0
2Z(g)����H>0
B���������������䣬�����¶ȣ������淴Ӧ���ʾ�����X��ת���ʼ�С
C���ﵽƽ����������������䣬��С���������ƽ�����淴Ӧ�����ƶ�
D���ﵽƽ����������������䣬ͨ��ϡ�����壬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��14 ���ͣ��ƶ���
��ʽ̼��ͭ������������;�㷺�Ļ���ԭ�ϡ�
��1����ҵ�Ͽ������Կ�ʴ��Һ����Ҫ�ɷ���Cu2+��Fe2+��Fe3+��H +��Cl?���Ʊ���ʽ̼��ͭ�����Ʊ��������£�
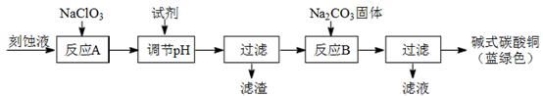
��֪��Cu2+��Fe2+��Fe3+���ɳ�����pH���£�
���� | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
��ʼ����pH | 4.2 | 5.8 | 1.2 |
��ȫ����pH | 6.7 | 8.3 | 3.2 |
�������Ƶ������� ��
�ڷ�ӦA�������Һ��pH��ΧӦΪ ��
�۵�һ�ι��˵õ��IJ�Ʒϴ��ʱ������ж��Ѿ�ϴ���� ��
���������ɫ��Ʒ�л���CuO���ʵ�ԭ���� ��
��2��ijѧϰС����ʵ������������ͼ��ʾװ����ȡ������̽�������ʡ�
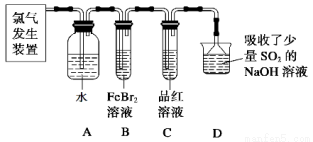
��ʵ�����ö������̺�Ũ���������ȡ����������������Ҫ��©�� ��
����C��Ʒ����Һ��ɫ���ܷ�֤��������ˮ��Ӧ�IJ�����Ư���ԣ�˵��ԭ�� ����ʱBװ���з�����Ӧ�����ӷ���ʽ�� ��
��д��A��Һ�о���ǿ���������Ļ�ѧʽ ������A��Һ�м���NaHCO3��ĩ����۲쵽�������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com