
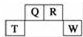
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: .
.分析 根据短周期元素Q、R、T、W在元素周期表中的位置知,Q和R位于第二周期、T和W位于第三周期,T所处的周期序数与主族序数相等,则T是Al元素,可推知Q是C元素、R是N元素、W是S元素;
(1)T为Al元素,原子核外有13个电子,各层电子数为2、8、3;
(2)Q是C、W是S元素,同一周期元素,元素非金属性随着原子序数增大而增强,同一主族元素,元素的非金属性随着原子序数增大而减弱;
(3)W是S元素,W的单质与其最高价氧化物的水化物浓溶液浓硫酸共热能发生反应,生成两种物质,其中一种是气体为二氧化硫,另一种是水;
(4)原子序数比R多1的元素是O元素,O元素的一种氢化物能分解为它的另一种氢化物,该氢化物是H2O2,H2O2分解生成H2O和O2;
(5)N有多种氧化物,其中甲的相对分子质量最小,为NO,在一定条件下,2L的NO与0.5L的O2相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的N的含氧酸盐只有一种,二者的物质的量之比为4:1,根据转移电子相等知,生成的含氧酸盐中N元素化合价为+3价.
解答 解:根据短周期元素Q、R、T、W在元素周期表中的位置知,Q和R位于第二周期、T和W位于第三周期,T所处的周期序数与主族序数相等,则T是Al元素,可推知Q是C元素、R是N元素、W是S元素;
(1)T为Al元素,原子核外有13个电子,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)Q是C、W是S元素,同一周期元素,元素非金属性随着原子序数增大而增强,非金属性S>Si,同一主族元素,元素的非金属性随着原子序数增大而减弱,非金属性C>Si,所以非金属性S>C,即Q弱于W,
故答案为:弱于;
(3)W是S元素,W的单质与其最高价氧化物的水化物浓溶液浓硫酸共热能发生反应,生成两种物质,其中一种是气体为二氧化硫,另一种是水,反应方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O,
故答案为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O;
(4)原子序数比R多1的元素是O元素,O元素的一种氢化物能分解为它的另一种氢化物,该氢化物是H2O2,H2O2分解生成H2O和O2,反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O;
(5)N有多种氧化物,其中甲的相对分子质量最小,为NO,在一定条件下,2L的NO与0.5L的O2相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的N的含氧酸盐只有一种,二者的物质的量之比为4:1,根据转移电子相等知,生成的含氧酸盐中N元素化合价为+3价,则含氧酸盐化学式为NaNO2,
故答案为:NaNO2.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及元素推断、氧化还原反应、元素周期律等知识点,侧重考查学生分析判断及知识综合运用能力,难点是(5)题化学式确定.


科目:高中化学 来源: 题型:选择题
| A. | 盐酸滴在大理石上:2H++CO32-═CO2↑+H2O | |
| B. | 硫酸滴在钢片上:Cu+2H+═Cu2++H2↑ | |
| C. | 向NaOH溶液中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 氢氧化铜与稀硫酸反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 降低压强 | C. | 及时分离出Z | D. | 使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
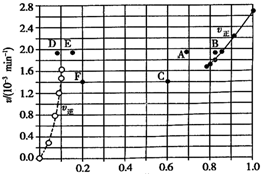 Bodensteins 研究了反应+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
Bodensteins 研究了反应+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:| l/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
| A. | 若升高温度到某一温度,则再次达到平衡时,相应点 可能分別是A、E | |
| B. | 若再次充人a molHI,则达到平衡时,相应点的播坐 标值不变,纵坐标值增大 | |
| C. | 若改变的条件是增大压强,则再次达到平衡时,相应 点与改变条件前相间 | |
| D. | 若改变的条件是使用催化剂.则再次达到平衡时,相 应点与改变条件前不间. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加NaOH,后加Na2CO3,再加BaCl2 | B. | 先加NaOH,后加BaCl2,再加Na2CO3 | ||
| C. | 先加Na2CO3,后加BaCl2,再加NaOH | D. | 以上答案皆可 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com