
【题目】反应A(g)+B(g)C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变.下列说法正确的是( ) 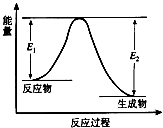
A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B.反应体系中加入催化剂,反应速率增大,△H不变
C.△H<0,反应达到平衡时,升高温度,A的转化率增大
D.△H>0,反应达到平衡时,升高温度,A的转化率减少
【答案】B
【解析】解:A.反应体系中加入催化剂,反应速率增大,E1、E2都减小,故A错误;
B.应体系中加入催化剂,活化能降低,反应速率增大,△H不变,故B正确;
C.反应物总能量大于生成物总能量,△H<0,反应达到平衡时,升高温度,平衡向逆反应方向移动,A的转化率减小,故C错误;
D.反应物总能量大于生成物总能量,△H<0,故D错误.
故选B.
【考点精析】利用反应热和焓变和化学平衡状态本质及特征对题目进行判断即可得到答案,需要熟知在化学反应中放出或吸收的热量,通常叫反应热;化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.离子晶体在熔化状态下能导电
B.在晶体中只要有阴离子就一定有阳离子
C.原子晶体中一定有非极性共价键
D.分子晶体中不一定含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为__________molL-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.200molL-1的稀盐酸。可供选用的仪器有:A胶头滴管;B量筒;C烧杯;D天平;E玻璃棒。
①配制稀盐酸时,上述仪器中不需要使用的有 (选填字母),还缺少的仪器有__________。
②该学生需要用__________mL量筒量取__________mL上述浓盐酸进行配制。
③配制稀盐酸时,在洗涤操作中,将洗涤液全部移入容量瓶,其目的是__________。
④配制稀盐酸时,在定容操作中,应在距刻度线__________处,改用胶头滴管滴加蒸馏水至液面与__________。
⑤若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”或“无影响”)定容时俯视刻度线__________;定容后经振荡、摇匀、静置,发现液面下降,再加适合的蒸馏水__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如下: 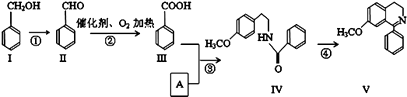
(1)Ⅱ中含氧官能团的名称 .
(2)反应②的化学方程式 .
(3)下列说法正确的是 .
A.Ⅰ和Ⅴ均属于芳香烃
B.Ⅱ能发生银镜反应
C.Ⅱ能与4molH2发生加成反应
D.反应③属于酯化反应
(4)A的结构简式 .
(5)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种.写出满足上述条件的Ⅵ的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X,M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是( )
(甲) XO3n﹣+Xn﹣+H+→X单质+H2O(未配平); (乙)Mm++mOH﹣=M(OH)m↓
①若n=1,则XO3n﹣中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m .
A.①③
B.②③
C.①②
D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如Fe+Cu2+=Fe2++Cu,可拆写为氧化反应式:Fe-2e-=Fe2+,还原反应式:Cu2++2e-=Cu。据此,回答下列问题:
(1)将反应Zn+2H+=Zn2++H2↑拆写为两个“半反应式”:
氧化反应式:_______________________,还原反应式:_______________________。
(2)将反应2Fe3++Cu=2Fe2++Cu2+拆写为两个“半反应式”:
氧化反应式:_______________________,还原反应式:_______________________。
(3)已知某反应的两个“半反应式”为:氧化反应式CH4+10OH--8e-=![]() +7H2O,还原反应式O2+2H2O+4e-=4OH-,则氧化还原反应方程式为___________________。
+7H2O,还原反应式O2+2H2O+4e-=4OH-,则氧化还原反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不可能通过观察法了解的金属钠的性质是 ( )
A.钠是一种银白色金属
B.熔点为97.81 ℃,密度为0.97 g·cm-3
C.钠与H2O剧烈反应
D.钠室温下氧化和在空气中燃烧得到不同的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学以反应2Fe3++2I﹣2Fe2++I2为原理,研究浓度对氧化还原性和平衡移动的影响.实验如图1: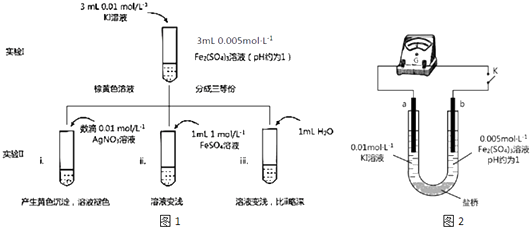
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 .
(2)iii是ii的对比试验,目的是排除有ii中造成的影响.
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化.用化学平衡移动原理解释原因: .
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原 因:外加Ag+使c(I﹣)降低,导致I﹣的还原性弱于Fe2+ , 用图2装置(a、b均为石墨电极)进行实验验证.①K闭合时,指针向右偏转,b作极.
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01molL﹣1 AgNO3溶液,产生的现象证实了其推测,该现象是 .
(5)按照(4)的原理,该同学用右图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因①转化原因是 .
②该实验与(4)实验对比,不同的操作是 .
(6)实验I中,还原性:I﹣>Fe2+;而实验II中,还原性:Fe2+>I﹣ , 将(3)和(4)、(5)作对比,得出的结论是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com