
| A、分子晶体中可能不含共价键 |
| B、原子晶体中只存在共价键 |
| C、离子晶体中一定含有离子键 |
| D、分子晶体中可能含有离子键 |


科目:高中化学 来源: 题型:
| A、25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B、在标准状况下,2.24 L CH2Cl2含有σ键的数目为0.4NA |
| C、某密闭容器盛有0.1molN2与0.3molH2,在一定条件下充分反应生成NH3,转移的电子数为0.6NA |
| D、向沸水中逐滴加入100 mL 0.1 mol/L饱和FeCl3溶液,形成的胶粒数小于0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
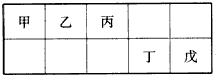
| A、最外层电子数:甲>乙>丙>丁>戊 |
| B、简单离子的离子半径:戊>丁>丙 |
| C、含有丁元素的酸有多种 |
| D、乙的氢化物多种多样,丙、丁、戊的氢化物各有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
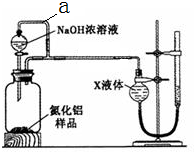 氮化铝(AlN)是一种新型无机材料.
氮化铝(AlN)是一种新型无机材料.样品 m1g |
| 过量NaOH溶液 |
| ① |
| 过量CO2 |
| ② |
| 过滤、洗涤 |
| ③ |
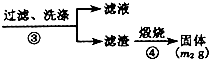
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3 |
| B、H2SO4 |
| C、NaHCO3 |
| D、NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com