
【题目】与氢气完全加成后,不可能生成2,2,3—三甲基戊烷的烃是( )
A.HC![]() CCH(CH3)C(CH3)3 B.CH2==CHC(CH3)2CH(CH3)2
CCH(CH3)C(CH3)3 B.CH2==CHC(CH3)2CH(CH3)2
C.(CH3)3CC(CH3)==CHCH3 D.(CH3)3CCH(CH3)CH==CH2
科目:高中化学 来源: 题型:
【题目】钛对于酸、碱具有较强的耐腐蚀性,密度小,比强度高。已成为化工生产中重要的材料。回答下列问题:
(1)基态钛原子的价电子排布式为______________,其原子核外未成对电子有_____个。金属钛晶胞如图所示,晶胞参数为a=b=295.08pm,c=468.55pm,α=β=90°,γ=120°。金属钛为____堆积(填堆积方式),其中钛原子的配位数为________。

(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为______晶体。
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
离子晶体 | KCl | CaO |
晶格能(kJ/mol) | 715 | 3401 |
解释KCl晶格能小于CaO的原因_________________________。
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是________。
(4)钙钛矿晶体的结构如图所示。晶体的化学式为___________。
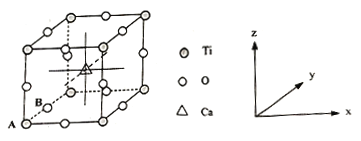
晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca离子的原子坐标为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数,下列叙述正确的是
A. 78 g Na2O2中含有的离子总数为4NA
B. 标准状况下,1.12 L HF中所含的分子总数为0.05 NA
C. 由CO2和O2组成的混合物共有Na个分子,其中的氧原子数为2 NA
D. 0.1 mol L-1 FeCl3溶液中含有的Cl-数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种常用的工业燃料,燃料乙醇的生产过程可由下图表示:
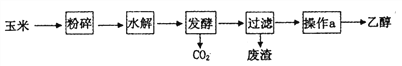
(1)粉碎玉米的目的是____________。
(2)生产过程中检验玉米中是否完全水解的方法是_________。
(3)请写出“发酵”过程中反应的化学方程式_____________;发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途:______________________、________________________
(4)操作a的名称是_________,检验乙醇中是否含有水可以用试剂______。
(5)根据上述生产过程,用5吨含淀粉70%的玉米,假设淀粉水解的百分率为85%,发酵过程的转化率为60%,则最终可以制得无水乙醇________kg(小数点后保留一位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子能在溶液中大量共存的是( )
A. Na+、Mg2+、Cl-、NO3- B. SO42-、Fe2+、K+、OH-
C. Ba2+、Cu2+、SO42-、Cl- D. HCO3-、CO32-、K+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 利用丁达尔效应可以区分溶液和胶体
B. 所有金属元素都可以用焰色反应来鉴别
C. 水泥、玻璃、光导纤维的主要成分都属于硅酸盐
D. pH值小于7的雨水称为酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用。
I.氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
(1)操作A、B的名称分别是______、_____;加入稍过量的NH4HCO3溶液的作用是_______。
(2)写出在空气中充分加热煅烧FeCO3的化学方程式:__________。
II.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00g,加入足量稀H2SO4溶解,并加水稀杯至100mL;
b.量取25.00mL待测溶液于锥形瓶中;
c.用酸化的0.01000mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c2~3次,得出消耗KMnO4溶液体积的平均值为20.00mL.
(3)写出滴定过程中发生反应的离子方程式:_________。
(4)确定滴定达到终点的操作及现象为_________。
(5)上述样品的质量分数为_________。
(6)下列操作会导致样品中Fe2O3的质量分数的测定结果偏低的有______。
a.未干澡锥形瓶 b.盛装标准液的滴定管没有用标准液润洗
c.滴定结束时仰视刻度线读数 d.量取待测液的滴定管没有润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明乙酸是弱酸的事实是
A. 乙酸和水能以任意比例混溶
B. 在稀乙酸水溶液中含有未电离的乙酸分子
C. 乙酸与Na2CO3溶液反应放出CO2气体
D. 1 mol·L-1的乙酸水溶液能使紫色石蕊溶液变红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com