
【题目】钛对于酸、碱具有较强的耐腐蚀性,密度小,比强度高。已成为化工生产中重要的材料。回答下列问题:
(1)基态钛原子的价电子排布式为______________,其原子核外未成对电子有_____个。金属钛晶胞如图所示,晶胞参数为a=b=295.08pm,c=468.55pm,α=β=90°,γ=120°。金属钛为____堆积(填堆积方式),其中钛原子的配位数为________。

(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为______晶体。
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
离子晶体 | KCl | CaO |
晶格能(kJ/mol) | 715 | 3401 |
解释KCl晶格能小于CaO的原因_________________________。
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是________。
(4)钙钛矿晶体的结构如图所示。晶体的化学式为___________。
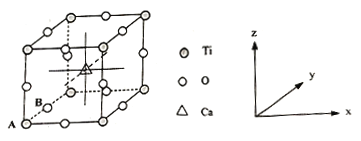
晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca离子的原子坐标为_____________。
【答案】 3d24s2 2 六方最密 12 分子 KCl、CaO均形成的是离子晶体,而K+半径大于Ca2+,K+电荷量小于Ca2+的、Cl—半径大于O2—,Cl—电荷量小于O2—的;故KCl晶格能小于CaO的晶格能 O>N>C CaTiO3 (![]() ,
, ![]() ,
, ![]() )
)
【解析】(1)钛原子的核电荷数为22,其电子排布式为[Ar]3d24s2 ,价电子排布式为3d24s2,其原子核外d轨道未成对电子有2个。如图所示,金属钛为六方最密堆积,其中钛原子的配位数为12;
(2)TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃;,由此可判断 TiCl4是由共价键结合的分子,晶体类型属于分子晶体;
(3)KCl、CaO均形成的是离子晶体,而K+半径大于Ca2+,K+电荷量小于Ca2+的、Cl—半径大于O2—,Cl—电荷量小于O2—的;故KCl晶格能小于CaO的晶格能;非金属性越强电负性越大,C、N、O三元素非金属性强弱顺序为O>N>C,则电负性由大到小的顺序是O>N>C;
(4)这个晶胞对位于顶点上的每个钛原子占有的份额为![]() ,所以,它单独占有的钛原子个数为8×
,所以,它单独占有的钛原子个数为8×![]() =1个;它对位于棱上的每个氧原子占有的份额为
=1个;它对位于棱上的每个氧原子占有的份额为![]() ,所以,它单独占有的氧原子个数为12×
,所以,它单独占有的氧原子个数为12×![]() =3个;它全部拥有体内的那一个钙原子,所以,该晶胞中单独占有的钛原子、氧原子和钙原子的个数分别为:1、3、1;所以,该化合物的化学式为CaTiO3。Ca为晶胞立体晶体的中心,则Ca离子的原子坐标为(
=3个;它全部拥有体内的那一个钙原子,所以,该晶胞中单独占有的钛原子、氧原子和钙原子的个数分别为:1、3、1;所以,该化合物的化学式为CaTiO3。Ca为晶胞立体晶体的中心,则Ca离子的原子坐标为(![]() ,
, ![]() ,
, ![]() )。
)。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )

A. 该分子的分子式C5H4
B. 1mol该物质完全燃烧生成CO2与H2O时需耗6 mol O2
C. 该物质完全燃烧生成的CO2与H2O的分子数比为5:4
D. 1mol该物质完全燃烧生成CO2与H2O时转移电子数为24 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中,按熔点由高到低的顺序排列正确的是
A. CH4>SiH4>GeH4>SnH4 B. KCl>NaCl>MgCl2>MgO
C. Rb>B>Na>Li D. 金刚石>Si>钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对充有氖气的霓红灯管通电,灯管发出红色光。产生这一现象的主要原因( )
A. 电子由激发态向基态跃迁时以光的形式释放能量
B. 电子由基态向激发态跃迁时吸收除红光以外的光线
C. 氖原子获得电子后转变成发出红光的物质
D. 在电流作用下,氖原子与构成灯管的物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代煤化工产生的H2S是一种重要的工业资源。请回答:
(1)用过量的NaOH吸收H2S,请写出该反应的离子方程式:____________。硫化钠又称臭碱,其溶液盛装在带橡胶塞的试剂瓶中,请用离子方程式解释其溶液呈碱性的原因为:_______。己知:25℃时,H2S的Ka1=1×10-7,Ka2=1×10-12,计算此温度时1mol/LNa2S溶液的pH=____。(结果取整数)
(2)用电解法处理Na2S溶液是处理硫化氢废气的一个重要环节。实验装置如图:

已知阳极的反应为xS2--2(x-1)e-=Sx2-,则阴极的电极反应式是_________,当反应转移nmole-时,产生标准状况下的气休体积为__________________。
(3)H2S是煤化工原料气脱硫过程的重要中间体。反应原理为:
①COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ/mol
CO2(g)+H2(g) △H=-42kJ/mol
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS | H2 | H2O | CO | H2S | CO2 |
能量/kJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
计算表中x=____________。
(4)向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平衡体积分数增大,解释其原因为_____________。平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,则H2O的平衡转化率为______,反应②的平衡常数为______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种安全无毒的物质,可杀菌和供氧,用于鱼苗养殖。带有数量不等的结晶水,通常还含有部分氧化钙.
(1)称取0.542 g过氧化钙样品,灼热时发生如下反应:2(CaO2xH2O)![]() 2CaO+O2↑+2xH2O,得到的O2在标准状况下体积为67.2 mL.该样品中CaO2的物质的量为_______________.
2CaO+O2↑+2xH2O,得到的O2在标准状况下体积为67.2 mL.该样品中CaO2的物质的量为_______________.
(2)另取同一样品0.542 g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70 g.
①试列式计算样品中CaO的质量_______________.
②试列式计算样品中CaO2xH2O的x值________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种常用的化工原料。实验室制备溴苯的实验步骤如下:

步骤1:在a中加入20mL苯和少量铁屑,再将b中4.0 mL液溴慢慢加入到a中充分反应.将b 中的液溴慢慢加入到a中,而不能快速加入的原因是_______________。继续滴加液溴至完全加入。装置d的作用是___________________。
步骤2:向a中加入15mL水,然后_____________(填操作名称)除去未反应的铁屑。
步骤3:再依次用10mL水、8mL10%的Na0H溶液、10mL水洗涤,分液得粗溴苯。Na0H溶液洗涤的作用是________________。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙.静置、过滤即得粗产品。加入氯化钙的目的是_______。
已知溴、苯、溴苯的有关物理性质如下表:
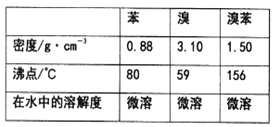
(1)实验装置中,仪器c的名称为______________,作用是冷凝回流.回流的主要物质有_______________(填化学式)。
(2)步骤4得到的粗产品中还含有杂质苯,则要进一步提纯粗产品,还必须进行的实验操作名称是_______________。
(3)在该实验中,a的容积最适合的是_________(填入正确选项前的字母)。
A.500mL B. 250 mL C.10O mL D.50 mL
(4)若步骤4的粗产品经进一步精制得到5.7mL的溴苯,则该实验中溴苯的产率是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与氢气完全加成后,不可能生成2,2,3—三甲基戊烷的烃是( )
A.HC![]() CCH(CH3)C(CH3)3 B.CH2==CHC(CH3)2CH(CH3)2
CCH(CH3)C(CH3)3 B.CH2==CHC(CH3)2CH(CH3)2
C.(CH3)3CC(CH3)==CHCH3 D.(CH3)3CCH(CH3)CH==CH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com