
【题目】对充有氖气的霓红灯管通电,灯管发出红色光。产生这一现象的主要原因( )
A. 电子由激发态向基态跃迁时以光的形式释放能量
B. 电子由基态向激发态跃迁时吸收除红光以外的光线
C. 氖原子获得电子后转变成发出红光的物质
D. 在电流作用下,氖原子与构成灯管的物质反应
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是( )
A. 胶体能产生丁达尔现象 B. 胶体是纯净物,其他分散系是混合物
C. 胶体的分散质能透过滤纸 D. 胶体的分散质粒子直径在1~100nm之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为 ,下列有关A的说法中正确的是( )
,下列有关A的说法中正确的是( )
A. 常温下,1molA能消耗2molNaOH
B. 1molA与足量的金属钠反应能生成22.4L氢气
C. 1 molA完全燃烧能消耗6molO2
D. A在一定条件下发生酯化反应能生成六元环酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高倩同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各式表示水解反应的是( )
A.HCO3﹣+H2OH3O++CO32﹣
B.HS﹣+H2OH2S+OH﹣
C.HSO3﹣+H2OSO32﹣+H3O+
D.HCO3﹣+OH﹣H2O+CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛对于酸、碱具有较强的耐腐蚀性,密度小,比强度高。已成为化工生产中重要的材料。回答下列问题:
(1)基态钛原子的价电子排布式为______________,其原子核外未成对电子有_____个。金属钛晶胞如图所示,晶胞参数为a=b=295.08pm,c=468.55pm,α=β=90°,γ=120°。金属钛为____堆积(填堆积方式),其中钛原子的配位数为________。

(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为______晶体。
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
离子晶体 | KCl | CaO |
晶格能(kJ/mol) | 715 | 3401 |
解释KCl晶格能小于CaO的原因_________________________。
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是________。
(4)钙钛矿晶体的结构如图所示。晶体的化学式为___________。
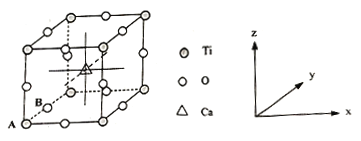
晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca离子的原子坐标为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫菜中含有比较丰富的碘,通常以KI形式存在。KMnO4是强氧化剂,能氧化H2O2、SO32—、Br—、I—、S2—、Fe2+等。某化学兴趣小组拟对市面上销售的某品牌紫菜进行碘的提取和含碘量测定,设计了如下实验步骤:
A.将灼烧后的紫菜灰溶于水,配成悬浊液,过滤
B.将水溶液和试剂甲加入分液漏斗中,震荡后静置,放出下层溶液备用
C.取干燥的紫菜m g于坩埚中灼烧
D.向滤液中滴加少量硫酸酸化的3%的H2O2溶液a ml,充分反应
E.对下层溶液进行某操作,得到碘单质并回收试剂甲
(1)对上述实验步骤进行合理的排序:__________________________________。
(2)步骤D中发生的离子反应为:____________________________________________。
小组中甲同学分析实验时认为步骤D中的H2O2可能有剩余,故取少量酸性高锰酸钾溶液,向其中滴加D中反应后的溶液,若溶液的紫色褪去,则说明H2O2还剩余。小组乙同学认为该结论存在不严谨的地方,请指出你认为不严谨的地方:__________________________
(3)步骤E中“某操作”是_____________。
(4)若实验用的H2O2溶液的密度为1g/cm3,假定所加H2O2溶液恰好完全反应完,则该紫菜中碘的含量可表示为:_______________g/100g(结果不化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法中正确的是
A.1mol/L盐酸溶液中含H+ 1 mol
B.常温常压下,1mol CH4的质量为16g/mol
C.28g C2H4和C3H6混合气体原子数目为6NA
D.标准状况下,2.24 L H2O中所含原子数均为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种常用的工业燃料,燃料乙醇的生产过程可由下图表示:
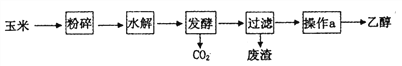
(1)粉碎玉米的目的是____________。
(2)生产过程中检验玉米中是否完全水解的方法是_________。
(3)请写出“发酵”过程中反应的化学方程式_____________;发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途:______________________、________________________
(4)操作a的名称是_________,检验乙醇中是否含有水可以用试剂______。
(5)根据上述生产过程,用5吨含淀粉70%的玉米,假设淀粉水解的百分率为85%,发酵过程的转化率为60%,则最终可以制得无水乙醇________kg(小数点后保留一位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com