
 H++Cl-+HClO。下列说法中确的是
H++Cl-+HClO。下列说法中确的是A.光照一段时间后,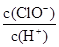 增大 增大 |
| B.加入碳酸钙粉末后,溶液的pH增大 |
| C.加入少量水,由水电离的c(H+)减小 |
| D.加入NaOH固体,一定有c(Na+)>c(Cl-)>c(H+)>c(ClO-)) |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 2R(g)△H>0,y 轴表示的是
2R(g)△H>0,y 轴表示的是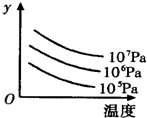
| A.平衡时,混合气中R的百分含量 | B.G的转化率 |
| C.平衡时,混合气中G的百分含量 | D.L的转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2S(g) △H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
H2S(g) △H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 B(g)+C(g);ΔH ="-48.25" kJ · mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)="1.6" mol·L-1,则下列结论正确的是
B(g)+C(g);ΔH ="-48.25" kJ · mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)="1.6" mol·L-1,则下列结论正确的是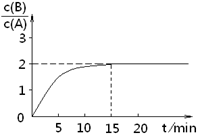
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是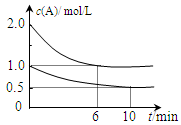
查看答案和解析>>
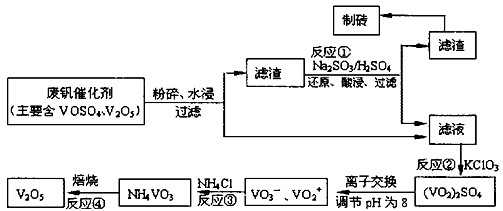
科目:高中化学 来源:不详 题型:计算题
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
 2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为
2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为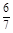 。
。 2SO3(g) 的平衡常数为_____;
2SO3(g) 的平衡常数为_____;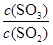 增大的是_____。
增大的是_____。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
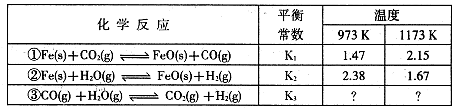
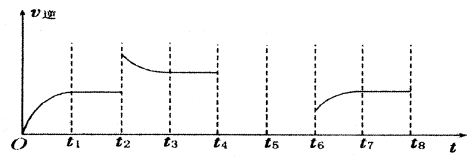
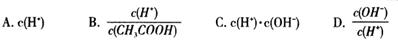
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2HI(g)达到平衡的标志是
2HI(g)达到平衡的标志是| A.H2、I2、HI的浓度相等 |
| B.H2、I2、HI的浓度之比为1:1:2 |
| C.混合气体的平均相对分子质量不变 |
| D.混合气体的颜色不再改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com