
 pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是

科目:高中化学 来源:不详 题型:单选题
 2AB3(g),分别在某一同时刻测得其中AB3所占的体积分数变化如图所示,下列说法不正确的是
2AB3(g),分别在某一同时刻测得其中AB3所占的体积分数变化如图所示,下列说法不正确的是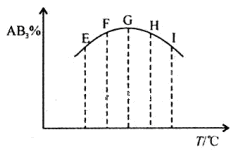
| A.正反应是放热反应 | B.E、F二点尚未达到平衡 |
| C.H、I二点尚未达到平衡 | D.G、H、I三点已达平衡状态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H++Cl-+HClO。下列说法中确的是
H++Cl-+HClO。下列说法中确的是A.光照一段时间后,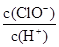 增大 增大 |
| B.加入碳酸钙粉末后,溶液的pH增大 |
| C.加入少量水,由水电离的c(H+)减小 |
| D.加入NaOH固体,一定有c(Na+)>c(Cl-)>c(H+)>c(ClO-)) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
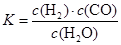
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 |
| B.某温度时,纯水中c(H+)=2×10-7mol·L-1,则c(OH-)=5×10-8mol·L-1 |
C.N2(g)+3H2(g) 2NH3(g),其他条件不变,增大压强,v(正)增大而v(逆)减小 2NH3(g),其他条件不变,增大压强,v(正)增大而v(逆)减小 |
D.Na2CO3溶液中存在平衡:CO32-+H2O HCO3-+OH一,升高温度溶液碱性增强 HCO3-+OH一,升高温度溶液碱性增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
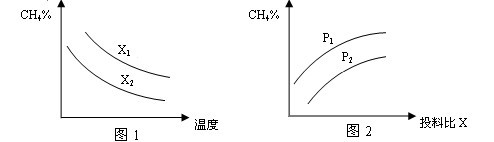
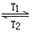 WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是
WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是| A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W,W重新沉积到灯丝上 |
| B.灯丝附近温度越高,WI2(g)的转化率越低 |
C.该反应的平衡常数表达式是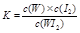 |
| D.利用该反应原理可以提纯钨 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是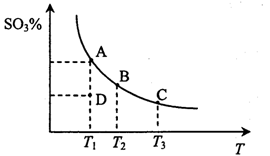
 2SO3(g)的△H<0
2SO3(g)的△H<0查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是 | A.①③⑤ | B.②⑥ | C.④⑤ | D.④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com