
【题目】按下列要求作答.
(1)宇宙中含量最高的元素为(填元素符号).
(2)第四周期中第一电离能最小的元素的最高价氧化物的水化物的电子式为 .
(3)电负性最大的元素的原子核外电子排布式为 .
(4)第二周期中,第一电离能介于B和N之间的元素共有种.
(5)最外层电子排布为4s24p1的原子的核电荷数为
(6)前36号元素中,未成对电子数最多的元素在周期表中的位置为 , 它位于 区.
(7)地球上的元素绝大多数是金属,非金属 (包括稀有气体)仅应 种.
【答案】
(1)H
(2)![]()
(3)1s22s22p5
(4)3
(5)31
(6)第四周期第ⅥB族; d
(7)22
【解析】解:(1)宇宙中含量最多为H,占90.8%左右;
所以答案是:H;(2)第四周期中第一电离能最小的元素为钾,最高价氧化物的水化物为氢氧化钾,电子式为: ![]() ;
;
所以答案是: ![]() ;(3)电负性最大的元素为F,核外有两个电子层,原子核外电子排布式为:1s22s22p5;
;(3)电负性最大的元素为F,核外有两个电子层,原子核外电子排布式为:1s22s22p5;
所以答案是:1s22s22p5;(4)同周期随原子序数增大,元素第一电离能呈增大趋势,当ⅡA族的s能级为全满稳定状态,ⅤA族的p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素,
所以答案是:3;(5)电子排布为4s24p1的原子中其内层电子层上完全排满电子,所以该原子中电子数=2+8+18+3=31,原子中核外电子数=核电荷数,所以它的核电荷数为 31,
所以答案是:31;(6)1~36号元素,未成对电子数最多的元素外围电子排布为3d54s1,共有6个未成对电子,该元素是铬,处于周期表中第四周期第ⅥB族,位于d区;
所以答案是:第四周期第ⅥB族;d;(7)地球上的元素绝大多数是金属,非金属共22种;
所以答案是:22.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】碘化钾是一种无色晶体。易溶于水。实验室制备KI晶体的步骤如下:
I.在如图所示的三颈烧瓶中加入127g研细的单质I2和195g30%KOH溶液,搅拌(已知:I2与KOH反应产物之一是KIO3);
II.碘完全反应后,打开分液漏斗中的活塞、弹簧夹,向装置C中通入足量的H2S;
III.反应结束后,向装置C中加入稀H2SO4酸化,水浴加热;
IV.冷却,过滤得KI粗溶液。
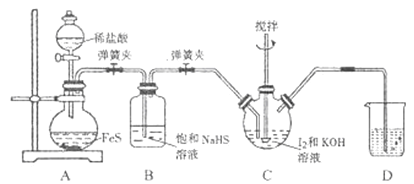
(1)检查装置A气密性的方法是______,步骤I控制KOH溶液过量的目的是______。
(2)装置B的作用是______,装置D中盛放的溶液是______ 。
(3)写出装置C中H2S和KIO3反应的离子方程式: ______ 。
(4)步骤III中水浴加热的目的是除去______ (填化学式)。
(5)由步骤IV所得的KI粗溶液(含SO42-)制备KI晶体的实验方案:边搅拌边向溶液中加入足量的______ (填化学式,下同),充分搅拌、过滤、洗涤并检验后,将滤液和洗涤液合并,加入HI溶液调至弱酸性,在不断搅拌下蒸发至较多固体析出,停止加热,用余热蒸干,得到KI晶体。在测定产品中KI含量时,测得其含量为101.5%,其原因可能是产品中含有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法中正确的是
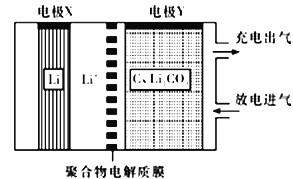
A. 该电池放电时,Li+向电极X方向移动
B. 该电池充电时,每转移0.4mol电子,理论上阳极产生4.48L.CO2
C. 该电池放电时,每转移4mol电子理论上生成1molC
D. 该电池充电时,阳极反应式为C+2Li2CO3-4e-==3CO2↑+4Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学中常见的物质。在一定条件下,它们之间的转化关系如下图所示(部分产物已略去)。
![]()
回答下列问题:
(1)若X是空气的主要成分之一,则A不可能是_____(填代号)。
a.Na b.C c.S d.Al
(2)若A常用作制冷剂,C为红棕色气体。写出由A生成B的化学方程式___________。
(3)若C可用于治疗胃酸过多,X是一种常见的温室气体。
①鉴别等浓度的B溶液和C溶液,可选用的试剂为______________(填化学式)。
②将A、B、C三种溶液混合,向45mL混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如下图所示。
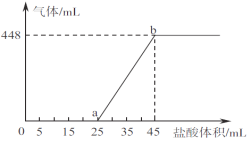
写出ab段所发生反应的离子方程式__________________________;b点对应溶液中溶质的物质的量浓度为___________(忽路溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义。某兴趣小组设计了如下处理方案。
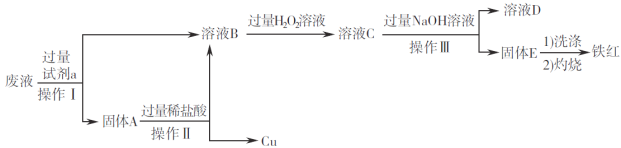
回答下列问题:
(1)固体A的成分是______________(填化学式)。
(2)由溶液B生成溶液C的离子方程式为___________________;检验溶液C中金属阳离子的试剂是____(填名称)。
(3)检验固体E是否洗涤干净的操作为____________________________;灼烧时,用于盛放固体E的仪器为____________________________(填名称)。
(4)铁红用途广泛,可用于焊接钢轨,写出该反应的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2(亚氯酸纳)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是
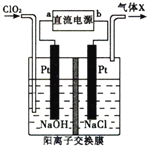
A. 若直流电源为铅蓄电池,则b极为Pb
B. 阳极反应式为ClO2+e-=ClO2-
C. 交换膜左测NaOH的物质的量不变,气体X为Cl2
D. 制备18.1gNaClO2时理论上有0.2molNa+由交换膜左侧向右侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁在工农业生产中具有广泛的应用。该物质不稳定,受热易分解产生氧化物,具有较强的还原性。
Ⅰ.某学习小组利用如下装置米探究FeSO4受热分解的产物。
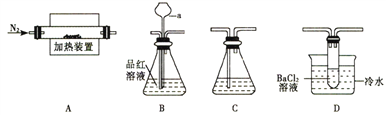
(1)甲组同学利用“A接B接C”的装置来验证产物中含有SO2气体。
①连接好装置后,接下来的操作是____________________。
②仪器a的名称是_______________;其作用是____________________。
(2)乙组同学查阅资料得:硫酸亚铁分解的气体产物中除SO2外还有SO3;SO3的熔点为16.8℃,沸点是46.8℃,溶于水放出大量的然,易形成酸雾。为此设计了“A接D接C”的装置验证产物中含有SO3。
①装置D中的现象是_________________,BaCl2溶液不能用Ba(NO3)2溶液代替的原因是______________________。
②装置A中固体变为经红棕色,结合两组同学的实验,写出硫酸亚铁分解的化学方程式______________________。
③取硫酸亚铁样品18.20g,加热分解至恒重时测得固体质量为11.00g(假设杂质不反应),该硫酸亚铁样品的纯度为__________%(保留小数点后两位,下同),样品中铁元素的质量分数为_____________。
Ⅱ.用硫酸亚铁碱性试纸可检验食品中是否含有CN-,方案如下:

已知:蓝色染料普鲁士蓝的合成方法如下:
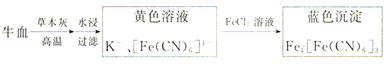
(3)若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请解释检测时试纸变蓝的原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,2.24 L![]() 中含有碳碳双键数为0.3NA
中含有碳碳双键数为0.3NA
B. 0.1mol甲烷和乙烯组成的混合气体完全燃烧,生成的水分子数为0.2NA
C. 0.1molCH4与0.1molCl2混合充分光照,生成CH3Cl分子数为0.1 NA
D. 0.1molN2和0.3molH2在高温、高压及催化剂下充分反应,产物的分子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com