
����Ŀ����NAΪ�����ӵ�������ֵ�������й�������ȷ����
A. ��״���£�2.24 L![]() �к���̼̼˫����Ϊ0.3NA
�к���̼̼˫����Ϊ0.3NA
B. 0.1mol�������ϩ��ɵĻ��������ȫȼ�գ����ɵ�ˮ������Ϊ0.2NA
C. 0.1molCH4��0.1molCl2��ϳ�ֹ��գ�����CH3Cl������Ϊ0.1 NA
D. 0.1molN2��0.3molH2�ڸ��¡���ѹ�������³�ַ�Ӧ������ķ�����Ϊ0.2NA
���𰸡�B
��������A��![]() �в�����̼̼˫������A����B���������ϩ��������ԭ����ͬ��0.1mol�������ϩ��ɵĻ��������ȫȼ�գ����ɵ�ˮ������Ϊ0.2NA����B��ȷ��C��0.1molCH4��0.1molCl2��ϳ�ֹ��գ����ڷ�ӦΪ���淴Ӧ�������ɶ���±����������CH3Cl������С��0.1 NA����C����D. 0.1molN2��0.3molH2�ڸ��¡���ѹ�������³�ַ�Ӧ�����ڷ�Ӧ�ǿ��淴Ӧ������ķ�����С��0.2NA����D����ѡB��
�в�����̼̼˫������A����B���������ϩ��������ԭ����ͬ��0.1mol�������ϩ��ɵĻ��������ȫȼ�գ����ɵ�ˮ������Ϊ0.2NA����B��ȷ��C��0.1molCH4��0.1molCl2��ϳ�ֹ��գ����ڷ�ӦΪ���淴Ӧ�������ɶ���±����������CH3Cl������С��0.1 NA����C����D. 0.1molN2��0.3molH2�ڸ��¡���ѹ�������³�ַ�Ӧ�����ڷ�Ӧ�ǿ��淴Ӧ������ķ�����С��0.2NA����D����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ������
��1�������к�����ߵ�Ԫ��Ϊ����Ԫ�ط��ţ���
��2�����������е�һ��������С��Ԫ�ص�����������ˮ����ĵ���ʽΪ ��
��3���縺������Ԫ�ص�ԭ�Ӻ�������Ų�ʽΪ ��
��4���ڶ������У���һ�����ܽ���B��N֮���Ԫ�ع����֣�
��5�����������Ų�Ϊ4s24p1��ԭ�ӵĺ˵����Ϊ
��6��ǰ36��Ԫ���У�δ�ɶԵ���������Ԫ�������ڱ��е�λ��Ϊ �� ��λ�� ����
��7�������ϵ�Ԫ�ؾ�������ǽ������ǽ��� ������ϡ�����壩��Ӧ �֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼͼ���У�������Ϊ����������ʵ�����������Ϊ����Һ�м��뷴Ӧ������ʵ���������Ӧ��ͼ������루1������4����Ӧ���� 
��Һ | �������� | ��Ӧ��ͼ�� |
�ű���ʯ��ˮ | ͨ����CO2���� | |
���Ȼ�����Һ | ���������ˮ | |
��MgCl2��AlCl3�Ļ��Һ | ��μ���NaOH��Һ������ | |
�Ⱥ�����NaOH��NaAlO2��Һ | ��μ���ϡ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ�����ĩ��Ʒ���ܺ���Fe2O3��Cu2O�е�һ�ֻ����֣�ij��ѧ��ԽС�������ɽ���̽����
��֪Cu2O��������Һ�лᷢ���绯��Ӧ:Cu2O+2H+=Cu+Cu2++H2O��
����һ:
(1)ѧ����ȡ������Ʒ���ձ��У��������Ũ���ᣬ����һ�ֺ���ɫ�����塣�ɴ˿ɵó���Ʒ��һ������_______��д��������������Ļ�ѧ����ʽ_____________��
(2)��һ��̽����Ʒ����һ�ֳɷ֡�ʵ���������Ϊ:ȡ����������Ӧ����Һ������______(�ѧʽ)��Һ���۲�����
������:
(3)ѧ����ȡ������Ʒ���ձ��У��������ϡ���ᣬ���������¼�����жϣ�������ȷ��____��
A.������ȫ���ܽ⣬˵����Ʒһ������Fe2O3��һ��������Cu2O
B.�����岿���ܽ⣬˵����Ʒһ������Cu2O��һ��������Fe2O3
C.������ȫ���ܽ⣬�ٵμ�KSCN��Һ����Һ�����ɫ��˵����Ʒһ������Fe2O3��Cu2O
������:
ѧ����������ͼ��ʾװ�ý���ʵ�飬������Ӧǰ��װ��C����Ʒ����������ȷ����Ʒ����ɡ��ش���������:
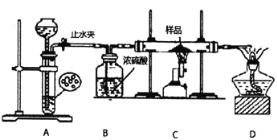
(4)װ��A�������ķ���װ�ã�����ʹ�õ�ҩƷ��______(��ѡ��)��
A.����������Һ����Ƭ B.ϡ�������Ƭ C.ϡ������пƬ D.Ũ�����þƬ
(5)����ʵ�鲽����Ⱥ�˳����_____(�����)��
�ٴ�ֹˮ�� �ڹر�ֹˮ�� �۵�ȼC���ľƾ����
��Ϩ��C���ľƾ���� ���ռ��������鴿
(6)������Ʒȫ���μӷ�Ӧ������Ӧ�������ʣ���ʵ��ǰ��Ʒ������Ϊ15.2g��ʵ���Ƶ�װ��C�й��������Ϊ12.0g������Ʒ�������(���ж��ֳɷ֣�����������ɷֵ�����)_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ������ġ���ɫ��Դ���������й����ܿ����ķ�ʽ����������ǣ� ��
A.��������ˮ��վ���õ����ֽ���ȡ����
B.���û�ʯȼ��ȼ�շ��ȣ����·ֽ�ˮ��������
C.�ڴ��������£�����̫���ֽܷ�ˮ
D.�������Ƚ������ᷴӦ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ѳ�Ϊ��ǰ��δ����ȫ���Ե��ش����֮һ��������Ϊ���������Ի����ƻ��������ĺ���ǣ� ��
������ɳĮ�� ������ ��ˮ��ԴΣ�� ���ϼ��ϳ����ն� ��ɳ������
A.�٢ڢ�
B.�٢ڢܢ�
C.�ڢ�
D.�٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú̿���ڲ���������Դ����Ч����������ú̿��Դ������Ҫ����ش��������⣺
��1��ú�ĸ���ú�ĸ���Ӧ�С�S_____0(�>����<����=��)��
��2��ú��Һ����ԭ����C(s)+H2O(g)![]() CO(g)+H2(g) ��H= akJ/mol��CO(g)+2H2(g)
CO(g)+H2(g) ��H= akJ/mol��CO(g)+2H2(g)![]() CH3OH(l) ��H=bkJ/mol����ӦC(s)+ H2O(g)+H2(g)
CH3OH(l) ��H=bkJ/mol����ӦC(s)+ H2O(g)+H2(g)![]() CH3OH(l) �ġ�H=______kJ/mol��
CH3OH(l) �ġ�H=______kJ/mol��
��3��ú��������ԭ����C(s) +2H2(g)![]() CH4(g) ��H����1L�ܱ�������Ͷ��1mol̼��������2 mol H2��������������ͼ��ʾ��
CH4(g) ��H����1L�ܱ�������Ͷ��1mol̼��������2 mol H2��������������ͼ��ʾ��

���й�ͼ1��ͼ2 ��˵����ȷ����______(����)��
a.�����ķ�Ӧ����v(Z) >v(X) >v(Y)
b.T1<1000K
c.ƽ�ⳣ��K(X)=K(Y) >K(Z)
d.��ҵ�����У����¶�ΪT2 ʱ��ѹǿԽ�ߣ�����Ч��Խ��
��ͼ2 ��A ���Ӧ��ƽ�ⳣ��Kp=_______(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
(4)ú����ˮú���Ͱ�ˮú����
�ٹ�ҵ����ú������Ϊ�ϳɰ�ԭ������ˮú����Ҫ��������(CO + H2) ��N2�����֮��Ϊ3.1-3.2�������ķ�Ӧ��C(s)+H2O(g)![]() CO(g) +H2(g).C(s) +1/2O2(g)
CO(g) +H2(g).C(s) +1/2O2(g)![]() CO(g)���������Ƕȿ��ǣ�ͨ�������Ŀ����__________��
CO(g)���������Ƕȿ��ǣ�ͨ�������Ŀ����__________��
����ͼ3�Ƿ�ӦCO(g) +H2O(g) ![]() H2(g)+ CO2(g) ��H<0 ��CO ��CO2��Ũ����ʱ�䷢���仯�����ߣ���t2ʱ�̸ı������������_______(д��1�ּ���)����t4 ʱ��ͨ���ı��ݻ��ķ�����ѹǿ����Ϊԭ����2 ������ͼ��t4~t5�����ڻ���CO��CO2Ũ�ȱ仯���ߣ�����������(���������״̬�����ֲ���)��________
H2(g)+ CO2(g) ��H<0 ��CO ��CO2��Ũ����ʱ�䷢���仯�����ߣ���t2ʱ�̸ı������������_______(д��1�ּ���)����t4 ʱ��ͨ���ı��ݻ��ķ�����ѹǿ����Ϊԭ����2 ������ͼ��t4~t5�����ڻ���CO��CO2Ũ�ȱ仯���ߣ�����������(���������״̬�����ֲ���)��________

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���س�ʯ(K2Al2Si6O16)ͨ��Ҳ������ʯ����Ҫ���������������մ���Ʒ������������ȡ�طʡ�ijѧϰС���Լس�ʯΪ��Ҫԭ�ϣ�������ȡ��������̼��ص����ʣ������������£�
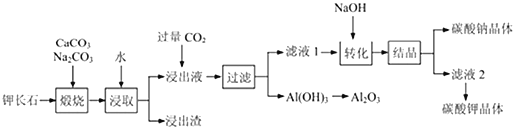
�ش��������⣺
(1)������������ɵ���ʽ��ʾ�س�ʯ�Ļ�ѧʽΪ_____________
(2)���չ��̺س�ʯ�еĹ�Ԫ����______________(�ѧʽ)����ʽ�����ڽ������У���֪��Ԫ�غ���Ԫ����Na2CO3������ת��Ϊ�����Ե�KAlO2��NaAlO2��д��Al2O3��Na2CO3��Ӧ����NaAlO2 �Ļ�ѧ����ʽ______________________________��
(3)����ȡ�������У���Ҫ���س�ʯ�ɿ�״�������Ϊ��С��������Ŀ����___________
(4)��ת����ʱ����NaOH��Һ��������_________________________ (�����ӷ���ʽ��ʾ)
(5)�˹����п���ѭ�����õ���Ҫ������___________��___________��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̪ݼ����ˮ�п��γɷ�ɢ������ֱ��Լ2 nm�ķ�ɢϵ���÷�ɢϵ�ǣ� ��
A.��ҺB.����C.����ҺD.�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com