
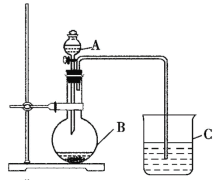
����Ŀ��ijͬѧ��ͨ���Ƚ�����������Ӧ��ˮ���������ǿ������֤̼���ķǽ�����ǿ��������������ͼ��ʾ��װ�ý���ʵ�顣��ش��������⣺
��1������B��������______��Ӧʢ������ҩƷ�е�______������ţ���
a��̼��� b�������� c���Ȼ��� d����������
��2������A��������______��Ӧʢ������ҩƷ�е�______������ţ���
a��ϡ���� b�������� c�������� d��ϡ����
��3������C��Ӧʢ�ŵ�ҩƷ��______��������______����ʵ����������֤��______�����Ա�______ǿ��______�ķǽ����Ա�______ǿ��
��4��B�з�����Ӧ�����ӷ���ʽΪ____________________��C�з�����Ӧ�����ӷ���ʽΪ_______________��
��5����һͬѧ��Ϊ��ʵ�����в���֮��������Ϊ����֮����__________________��
���𰸡�Բ����ƿ a ��Һ©�� d ��������Һ C���а�ɫ��״�������� ̼�� ���� C ![]()
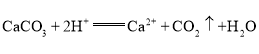
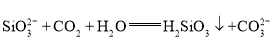 ������лӷ��ԣ����ܻ����C�У���ʵ���������
������лӷ��ԣ����ܻ����C�У���ʵ���������
��������
��ȻҪ�Ƚ�̼���ķǽ�����ǿ��������ͨ���Ƚ϶��ߵ�����������Ӧ��ˮ���������ǿ������˿�������ߵ�װ����ȡ![]() ���ұߵ�װ�÷�������Ƽ��ɡ�
���ұߵ�װ�÷�������Ƽ��ɡ�
��1��
����B��Բ����ƿ����ȻҪ��Һ����������![]() ����ôѡ��ϡ����+̼��ƱȽϺ��ʣ���ѡa��
����ôѡ��ϡ����+̼��ƱȽϺ��ʣ���ѡa��
��2������A�Ƿ�Һ©������װϡ���ᣬ��ѡd��
��3�����ݷ���������C��Ӧװ��������Һ��������C�в�����ɫ��״��������˵��![]() �����Ʒ�Ӧ�Ƶ���
�����Ʒ�Ӧ�Ƶ���![]() ����
����![]() ������ǿ��
������ǿ��![]() ����̼�ķǽ�����ǿ�ڹ裻
����̼�ķǽ�����ǿ�ڹ裻
��4��B�з���̼�����ϡ����ķ�Ӧ��д������ʽ![]() ��C�з����ķ�ӦΪ
��C�з����ķ�ӦΪ![]() ��
��
��5��������ܻӷ���������ӷ�����C��Ҳ�ܲ��������ɫ��������ʵ����ɸ��ţ���������B��C֮���һ��װ�б���ʳ��ˮ��ϴ��ƿ��


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��װ��(��)��һ�ֿɳ���أ�װ��(��)Ϊ���Ե缫�ĵ��ء�����˵���������
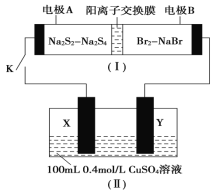
A.�պϿ���Kʱ���缫BΪ�������ҵ缫��ӦʽΪBr2+2e��===2Br��
B.װ��(��)���ʱ��Na��������ͨ�������ӽ���Ĥ
C.װ��(��)�ŵ�ʱ���ܷ�ӦΪ2Na2S2��Br2===Na2S4��2NaBr
D.��װ�õ�·����0.1mole��ͨ��ʱ���缫X����������2.56gCu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������A1N����һ���������ǽ������ϡ�ijA1N��Ʒ������Al2O3���ʣ�Ϊ�ⶨA1N�ĺ����������������ʵ�鷽����
��֪��AlN+NaOH+H2O=NaAlO2+NH3��
������һ��
ȡһ��������Ʒ��������װ�òⶨ��Ʒ��A1N�Ĵ��ȣ��г�װ������ȥ����
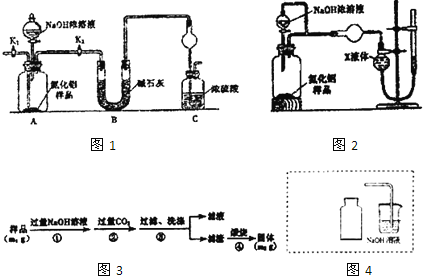
��1����ͼ1Cװ�������θ���ܵ�������___��
��2���������ʵ�鲽�裺��װ��ʵ��װ�ã�����___�ټ���ʵ��ҩƷ����������ʵ�������___����Һ©������������Ũ��Һ�������ٲ������塣��K1��ͨ�뵪��һ��ʱ�䣬�ⶨCװ�÷�Ӧǰ��������仯��ͨ�뵪����Ŀ����___��
��3������װ�ô���ȱ�ݣ����²ⶨ���ƫ�ߣ�������Ľ����____��
����������
����ͼ2װ�òⶨmg��Ʒ��A1N�Ĵ��ȣ����ּг�װ������ȥ����
��4��Ϊ�ⶨ������������������װ���е�XҺ�������___��
a��CCl4 b��H2O c��NH4Cl��Һ d����
��5����mg��Ʒ��ȫ��Ӧ�����������������ΪVmL����ת��Ϊ��״��������A1N����������____��
����������
����ͼ3����ⶨ��Ʒ��A1N�Ĵ��ȣ�
��6����������ɳ��������ӷ���ʽΪ____��
��7�����ڲ������δϴ�ӣ��ⶨ�����___������ƫ������ƫ����������Ӱ��������
��8��ʵ������ȡNO2���塣����ͼ4���߿��ڻ�����ͭ��Ũ������ȡ���ռ�NO2��װ�ü�ͼ___���г������ԣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ���ֶ����ڷǽ���Ԫ�ص�ԭ�Ӱ뾶��ԭ����������ͼ��ʾ�Ĺ�ϵ��������
���ֶ����ڷǽ���Ԫ�ص�ԭ�Ӱ뾶��ԭ����������ͼ��ʾ�Ĺ�ϵ��������![]() ��ˮú������Ҫ�ɷ�֮һ������˵������ȷ����
��ˮú������Ҫ�ɷ�֮һ������˵������ȷ����
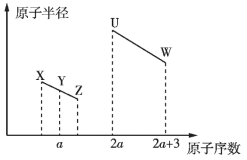
A.![]() ������������Һ��Ӧ����������ʽ��
������������Һ��Ӧ����������ʽ��
B.![]() ��
��![]() �γɵĻ������к������Ӽ�
�γɵĻ������к������Ӽ�
C.![]() ��
��![]() ��
��![]() Ԫ�ص�����������Ӧˮ���������������ǿ
Ԫ�ص�����������Ӧˮ���������������ǿ
D.��Ԫ��![]() ��ԭ����������
��ԭ����������![]() ����
����![]() ͬ���壬��
ͬ���壬��![]() �Ľ�����ǿ��
�Ľ�����ǿ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ���Ӧ�ڴ�������ķ�Ӧ���̼������仯��ͼ��ʾ������˵����ȷ����

A.����ѹǿ��������֮���������ֵ������
B.�ϳɰ������淴Ӧ���ʱ���ͬ
C.�ϳɰ��Ĺ��������ȷ�Ӧ
D.��ʹ�ô��������ɵ�����NH3��Ҫ��ʱ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в��ֶ�����Ԫ�ص������Ϣ���±���ʾ��
Ԫ�ش��� |
|
|
|
|
�����Ϣ | ��ˮ������������ߵ�Ԫ�� | ����⻯���ˮ��Һ�ʼ��� |
| ��������ǵ�3����Ԫ�صļ������а뾶��С�� |
��1��![]() ��Ԫ�����ڱ���λ�ڵ�______���ڵ�______�壻Ԫ��
��Ԫ�����ڱ���λ�ڵ�______���ڵ�______�壻Ԫ��![]() ��Ԫ��
��Ԫ��![]() ��ȣ������Խ�ǿ����______����Ԫ�ط��ű�ʾ����������֤����һ��ʵ����______������ţ���
��ȣ������Խ�ǿ����______����Ԫ�ط��ű�ʾ����������֤����һ��ʵ����______������ţ���
a��![]() ���ʵ��۵��
���ʵ��۵��![]() ���ʵĵ�
���ʵĵ�
b���ڻ�������![]() �Ļ��ϼ۱�
�Ļ��ϼ۱�![]() ��
��
c��![]() �ĵ���������ˮ���ҷ�Ӧ��
�ĵ���������ˮ���ҷ�Ӧ��![]() �ĵ��ʲ���
�ĵ��ʲ���
d��![]() ��
��![]() ͬ������
ͬ������![]() ��
��![]() ���Ҳ�
���Ҳ�
��2��![]() ��
��![]() Ԫ�ؿ��γɺ��й��ۼ��ij�����Ԫ���ӻ�����û�����Ļ�ѧʽΪ______���û����������Ӽ��빲�ۼ�����Ŀ��Ϊ______��
Ԫ�ؿ��γɺ��й��ۼ��ij�����Ԫ���ӻ�����û�����Ļ�ѧʽΪ______���û����������Ӽ��빲�ۼ�����Ŀ��Ϊ______��
��3��![]() ��
��![]() ���⻯��
���⻯��![]() ��
��![]() ��һ�������·�Ӧ�ɵõ�һ�ֵ��ʺ�һ�ֳ�����ΪҺ������ʣ���д���÷�Ӧ�Ļ�ѧ����ʽ��__________________________________________��
��һ�������·�Ӧ�ɵõ�һ�ֵ��ʺ�һ�ֳ�����ΪҺ������ʣ���д���÷�Ӧ�Ļ�ѧ����ʽ��__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������Һ���й��������ʵ���Ũ�ȹ�ϵ��ȷ����
A.pH��8��CH3COONa��Һ��c��CH3COOH����9.9��10��7 mol��L��1
B.0.1 mol��L��1Na2SO3��Һ��c��Na������c��H������c��SO32������c��HSO3������c��OH����
C.0.1 mol��L��1NaHCO3��Һ��c��Na������c��OH������c��HCO3������c��H2CO3����c��H����
D.0.1 mol��L��1CH3COONa��Һ��ͨ��HCl����ҺpH��7��c��Na����>c��CH3COOH��>c��Cl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ᶼ����Ҫ�Ĺ�ҵԭ�ϡ�
��1����״���£���500 L��������ˮ�γ�1 L��ˮ����˰�ˮ�����ʵ���Ũ��Ϊ__mol�� L-1��������λ��Ч���֣�����ҵ�ϳ��ù�����ˮ���ն������÷�Ӧ�Ļ�ѧ����ʽΪ__��
��2�����������ǹ�ҵ�����кϳ��������Ҫ;�����ϳɵĵ�һ���ǽ����Ϳ����Ļ����ͨ�����ȵIJ���Ͻ������ںϽ����Ĵ��£�����������һ���������÷�Ӧ�Ļ�ѧ����ʽΪ__��
���з�Ӧ�еİ��백�������еİ�������ͬ����__��
A��2Na+2NH3===2NaNH2+H2�� B��2NH3+3CuO===3Cu+N2+3H2O
C��4NH3+6NO===5N2+6H2O D��HNO3+NH3===NH4NO3
��ҵ�е�β��������ֻ��NO��NO2�����ռ�������գ���Ӧ�����ӷ���ʽΪ2NO2+2OH��===NO2-+NO3-+H2O��NO+NO2+2OH��===������+H2O����ƽ�÷���ʽ����______________
��3����27.2 g Cu��Cu2O�Ļ�����м���ijŨ�ȵ�ϡHNO3500 mL����Ӧ�����в���������ֻ��NO��������ȫ�ܽ����������Һ������������ֻ��Cu2+���м���1 L 1 mol��L-1��NaOH��Һʹ��������ǡ����ȫ��������ʱ��Һ�����ԣ����ó�������Ϊ39.2 g��
��Cu��ϡHNO3��Ӧ�����ӷ���ʽΪ__��
��Cu��Cu2O �����ʵ���֮��Ϊ__��
��HNO3�����ʵ���Ũ��Ϊ__mol��L-1��
��4����H2SO4��HNO3�Ļ����Һ20 mL������0.25 molL��1Ba��OH��2��Һʱ�����ɳ���������w��g����Ba��OH��2��Һ�����V��mL���Ĺ�ϵ��ͼ��ʾ��C ����Һ�����ԣ�����ԭ���Һ��H2SO4�����ʵ���Ũ��Ϊ__mol��L-1��HNO3�����ʵ���Ũ��Ϊ__mol��L-1��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�������Դ���⣬��ˮ�������õIJ��ֹ�����ͼ��ʾ�������й�˵������ȷ����( )
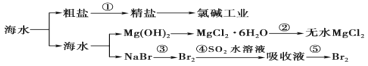
A.�ٴ����ƾ��γ����ù�����ɳ�⣬�������ȥ Ca2����Mg2����SO42-������
B.��ҵ�����г�ѡ��ʯ������Ϊ Mg2���ij����������Գ�������ϴ��
C.�ڢڲ��ķ�Ӧ�ǽ� MgCl26H2O �����ڿ�����ֱ�Ӽ�����ȥ�ᾧˮ����ˮ MgCl2
D.�ڢ۲����ڢݲ�������������ȡ��ˮ����ͨ��ʹ�� SO2 ����ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com