
【题目】室温下,将1mol的CuSO45H2O(s)溶于水会使溶液温度降低,热效应为△H1 , 将1mol的CuSO4溶于水会使溶液温度升高,热效应为△H2;CuSO45H2O(s)受热分解的化学方程式为CuSO45H2O(s) ![]() CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )
A.△H2>△H3
B.△H1<△H3
C.△H1+△H3=△H2
D.△H1+△H2>△H3
【答案】B
【解析】解:①胆矾溶于水时,溶液温度降低,反应为CuSO45H2O(s)=Cu2+(aq)+SO42﹣(aq)+5H2O(l)△H1>0;
②硫酸铜溶于水,溶液温度升高,该反应为放热反应,则:CuSO4(s)=Cu2+(aq)+SO42﹣(aq)△H2<0;
③已知CuSO45H2O(s)=CuSO4(s)+5H2O(l)△H3;
依据盖斯定律①﹣②得到③:△H3=△H1﹣△H2,由于△H2<0,△H1>0,则△H3>0,
A.分析可知△H3>0,而△H2<0,则△H3>△H2,故A错误;
B.上述分析可知:△H2<0,△H3>0,则△H2<△H3,故B正确;
C.△H3=△H1﹣△H2,则△H1=△H3+△H2,故C错误;
D.△H2<0,△H1>0,且△H1=△H3+△H2,则△H3>△H1+△H2,故D错误;
故选B.
胆矾溶于水时,溶液温度降低,该反应为吸热反应,则:CuSO45H2O(s)=Cu2+(aq)+SO42﹣(aq)+5H2O(l)△H1>0;
硫酸铜溶于水,溶液温度升高,说明该反应为放热反应,则:CuSO4(s)=Cu2+(aq)+SO42﹣(aq)△H2<0;
已知CuSO45H2O(s)=CuSO4(s)+5H2O(l)△H3,根据盖斯定律确定各焓变之间的关系,以此解答该题.


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.1mol/LBaCl2溶液中含有的钡离子数为NA
B.1mol镁原子中含有的电子数为2NA
C.常温常压下,11.2LH2O中含有的分子数为0.5NA
D.16gO3和O2的混合物中含有的氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO3﹣、MnO4﹣
B.K+、Na+、Cl﹣、SO42﹣
C.K+、Na+、Br﹣、Cu2+
D.Na+、Ba2+、OH﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( ) 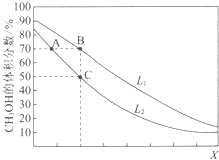
A.X代表压强
B.L1<L2
C.平衡常数:K(A)=K(B)
D.在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.固体氯化钠不导电,所以氯化钠是非电解质
B.铜丝能导电,所以铜是电解质
C.氯化氢水溶液能导电,所以氯化氢是电解质
D.SO3溶于水能导电,所以SO3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验: 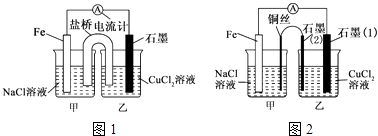
(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为 . 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过mol电子.
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式 , 这是由于NH4Cl溶液显(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因 .
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨为极(填正、负、阴、阳),乙装置中与铜线相连的石墨(2)电极上发生的反应式为 .
(4)在图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重 1.28g,则此时溶液的pH为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质及其化合物用途非常广泛。回答下列问题:
(1)基态磷原子价电子轨道表示式为______________________;磷的第一电离能比硫大,其原因是_____________________________________________。
(2)已知反应6P2H4==P4+ 8PH3↑。P2H4分子中磷原子杂化类型是________________;P4分子的几何构型是________________________。
(3)N和P同主族。
①NH3的沸点比PH3高,其原因是_________________________;NH3分子中键角比PH3分子中键角大,其原因是______________________________________________。
②氮原子间可形成氮氮双键或氮氮叁键,而磷原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________________________________________。
(4)磷化铟是一种半导体材料,其晶胞如下图所示,晶胞参数为a nm。In 的配位数为_______________;与In原子间距离为![]() a nm 的In 原子有________个。
a nm 的In 原子有________个。
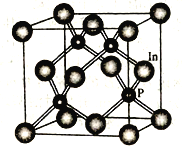
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是( )
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.H2、I2(g)混合气体加压后颜色变深
C.红棕色的NO2加压后颜色先变深再变浅
D.实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com