
【题目】近日,科学家发表了高温二氧化碳电解发展报告,利用固体氧化物电解池将CO2和H2O转化为合成气并联产高纯度O2。原理如图所示。下列说法正确的是
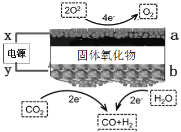
A.x极为电源正极
B.当有2 mol电子流向a极时,产生0.5 molO2
C.b极CO2的反应式:CO2+2H++2e-=CO+H2O
D.电解质中阴离子由a向b移动
科目:高中化学 来源: 题型:
【题目】已知可逆反应CO(g) + H2O (g)CO2(g) + H2(g),在830K温度下达到平衡。
(1)其化学平衡常数K的表达式为K= _______。
(2)830K时,若起始时:c (CO) = 2mol/L,c (H2O)=3mol/L,平衡时CO的转化率为60%, K值为________。
(3)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为_______。
(4)若830K时起始浓度c (CO)=a mol/L,c (H2O)=b mol/L,H2的平衡浓度c (H2)=c mol/L,①a、b、c之间的关系式是_________;
②当a = b时,a= ________c。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是优良的多功能水处理剂。某实验小组釆用如图装置制备高铁酸钾![]() 并探究其性质用途。
并探究其性质用途。
资料:![]() 为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性在酸性或中性溶液中紫色快速褪去并产生
为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性在酸性或中性溶液中紫色快速褪去并产生![]() ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
Ⅰ![]() 制备
制备![]() 夹持、加热等装置略
夹持、加热等装置略![]()
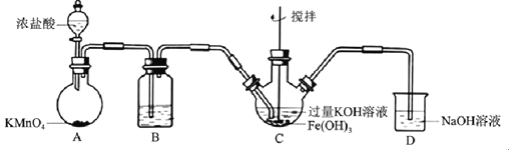
![]() 中所用试剂为______。
中所用试剂为______。
![]() 中反应为放热反应,而反应温度须控制在
中反应为放热反应,而反应温度须控制在![]() ,可使用的控温方法为______,充分反应后得到紫色固体,反应方程式为______。反应中KOH必须过量的原因是______。
,可使用的控温方法为______,充分反应后得到紫色固体,反应方程式为______。反应中KOH必须过量的原因是______。
![]() 中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用______。
中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用______。
![]() 冰水
冰水![]() 溶液
溶液![]() 异丙醇
异丙醇
Ⅱ![]() 探究
探究![]() 的性质
的性质
![]() 可以将废水中的
可以将废水中的![]() 氧化为
氧化为![]() ,实验表明,
,实验表明,![]() 时
时![]() 去除效果最佳。配平反应离子方程式:
去除效果最佳。配平反应离子方程式:
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() 。现处理含
。现处理含![]() 离子浓度为
离子浓度为![]() 的废水
的废水![]() ,至少需要
,至少需要![]() ______g。
______g。
![]() 资料表明,酸性溶液中氧化性
资料表明,酸性溶液中氧化性![]() 验证实验:将少量
验证实验:将少量![]() 溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入
溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入![]() 和
和![]() 的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有
的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池,将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是( )
2Na2CO3+C。下列说法错误的是( )
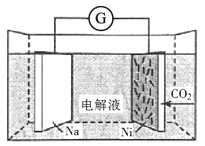
A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为3CO2+4e-=2CO32-+C
D.充电时,阳极反应为Na++e-=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:

(1)A中含氧官能团的名称为________和________。
(2)A→B的反应类型为________。
(3)C→D的反应中有副产物X(分子式为C12H15O6Br)生成,写出X的结构简式:________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物在生产生活中被广泛使用,造福人类。
(1)氟在元素周期表中的位置是___________。
(2)氢氟酸具有刻蚀玻璃的特性,写出该反应的化学方程式____________。已知25℃时,氢氟酸的电离平衡常数Ka=3.6×10-4,若将0.01 mol·L-1的HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度由大到小的顺序为_____。
(3)次氟酸(HOF)由科学家在1971年首次制得,次氟酸的电子式为_______。
(4)四氟肼(N2F4)用作高能燃料的氧化剂,1 mol N2F4分子中含有的共价键数目是________NA。N2F4气体可用Fe3+氧化二氟胺(HNF2)制得,写出该反应的离子方程式______________。
(5)六氟化铀(UF6)是铀的稳定气态化合物,用作核燃料,由U3O8制取UF6的三步反应原理如下:
①U3O8+H2 →UO2+H2O (未配平) ②UO2+4HF=UF4+2H2O ③UF4+ F2 = UF6
则下列说法正确的是 _____________。
A.反应①②③都是氧化还原反应
B.反应③中U元素被氧化
C.反应①中氧化剂和还原剂的物质的量之比为2:1
(6)六氟磷酸锂(LiPF6)是锂离子电池广泛使用的电解质。LiPF6与极少量水反应可生成POF3等三种含氟化合物,写出该反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2+ O2![]() 2SO3达到平衡的标志是
2SO3达到平衡的标志是
①消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A.①②B.①③C.只有③D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
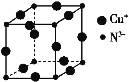
【题目】我国具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题:
(1)Cu+的核外电子排布式为_________。
(2)新型农药松脂酸铜具有低残留的特点,图是松脂酸铜的结构简式。加“*”碳原子的杂化方式为______。
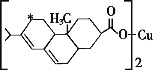
(3)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型为____,比较第一电离能:N__(填“>”或“<”)O。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醇的沸点明显高于乙醛,其主要原因为___________。
(5)某铜矿石的晶胞结构如图所示,写出其化学式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用![]() 溶液分别滴定
溶液分别滴定![]() 溶液和
溶液和![]() 溶液,得到2条滴定曲线,如下图所示:
溶液,得到2条滴定曲线,如下图所示:
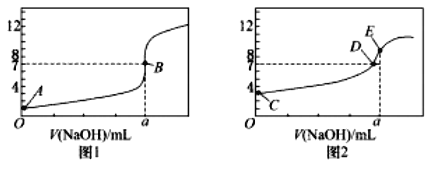
![]() 由A、C点判断,滴定HCl溶液的曲线是_____
由A、C点判断,滴定HCl溶液的曲线是_____![]() 填“图1”或“图2”
填“图1”或“图2”![]() ;
;
![]()
![]() ____
____![]() ;
;
![]()
![]() 的点是_________;
的点是_________;
![]() 点对应离子浓度由大到小的顺序为___________________________。
点对应离子浓度由大到小的顺序为___________________________。
![]() 当NaOH溶液滴定
当NaOH溶液滴定![]() 溶液过程中,NaOH溶液消耗了
溶液过程中,NaOH溶液消耗了![]() mL时,则此时混合液中
mL时,则此时混合液中![]() ____c
____c![]() “
“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 室温时,浓度均为
室温时,浓度均为![]() 的
的![]() 和NaOH的混合液
和NaOH的混合液![]() ,则溶液中
,则溶液中![]() ___________
___________![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com