
【题目】2004年4月15日,重庆某化工厂氯气泄露并发生爆炸,爆炸现场弥漫着黄色烟雾,这起事故共造成7人丧生,并致使近15万群众紧急疏散。问题:
(1)爆炸现场弥漫的黄色烟雾,除氯气外,形成雾的主要原因是Cl2与水反应,反应的化学方程式为___________________________________;形成烟的成分包含Cl2与Fe反应的产物___________,Cl2是一种有毒气体,为消除毒气,消防部门用消防用水与碱液在外围50米处形成两道水幕进行稀释,写出Cl2与强碱溶液反应的离子方程式__________________________________。
(2)Cl2及其无机产品常用做消毒剂,如“84消毒液”(NaClO)、“漂白粉”等,它们的消毒原理都是在潮湿的空气中与CO2和水蒸气反应生成了次氯酸,请写出“84消毒液”(NaClO)在空气中发生作用的化学方程式:________________________________。
(3)用氯气对饮用水消毒已经有百年的历史,这种消毒的方法中氯气会与水中的有机物发生氯代生成对人体有害的的氯代物,于是世界环保联盟建议推广广谱高效消毒剂二氧化氯(ClO2),制取二氧化氯的其中一种方法是:Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O,该反应中氧化剂是_______,还原剂是_______,氧化剂与还原剂的物质的量之比为_________;若生成1mol ClO2则转移电子数为____________(NA表示阿伏伽德罗常数)。
【答案】H2O+Cl2=HClO+HCl FeCl3 Cl2+2OH—=ClO—+Cl—+H2O 2NaClO+H2O+CO2=Na2CO3+2HClO NaClO3 Na2SO3 2:1 NA
【解析】
(1)Cl2与水反应生成盐酸和次氯酸,反应的化学方程式为H2O+Cl2![]() HClO+HCl;Cl2具有强氧化性,所以Cl2与Fe反应生成FeCl3;Cl2与强碱溶液反应生成盐酸盐、次氯酸盐和水,离子方程式为:Cl2+2OH—=ClO—+Cl—+H2O,故答案为:H2O+Cl2
HClO+HCl;Cl2具有强氧化性,所以Cl2与Fe反应生成FeCl3;Cl2与强碱溶液反应生成盐酸盐、次氯酸盐和水,离子方程式为:Cl2+2OH—=ClO—+Cl—+H2O,故答案为:H2O+Cl2![]() HClO+HCl;FeCl3;Cl2+2OH—=ClO—+Cl—+H2O。
HClO+HCl;FeCl3;Cl2+2OH—=ClO—+Cl—+H2O。
(2)NaClO在空气中发生作用是因为NaClO与空气中的二氧化碳反应生成HClO,HClO具有强氧化性,可以用于杀菌、消毒,反应的化学方程式为:2NaClO+H2O+CO2=Na2CO3+2HClO,故答案为:2NaClO+H2O+CO2=Na2CO3+2HClO。
(3)该反应Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O中,Na2SO3中S元素的化合价由+4价升高为+6价,则Na2SO3是还原剂,发生氧化反应,NaClO3中Cl元素的化合价由+5价降低为+4价,则NaClO3是氧化剂,发生还原反应,物质的量之比等于化学计量数之比,故氧化剂与还原剂的物质的量之比为2:1,由反应方程式可知,生成1个ClO2转移1个电子,故生成1mol ClO2则转移电子数为NA,故答案为:NaClO3;Na2SO3;2:1;NA。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定量的铁、铝合金与300mL 2mol/L硝酸完全反应生成3.36LNO(标况)和三价铁盐、铝盐等,再向反应后的溶液中加入3mol/L的NaOH溶液,使铝、铁元素完全沉淀下来,则所加NaOH溶液的体积是( )
A. 450mL B. 150mL C. 200mL D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第3周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图_____________ ;X元素的气态氢化物与其最高价含氧酸反应的离子方程式为______________;
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是__________(填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
尼龙是世界上出现的第一种合成纤维。尼龙的出现使纺织品的面貌焕然一新,它的合成是合成纤维工业的重大突破,同时也是高分子化学的一个重要里程碑。下图是以1,3—丁二烯为原料来合成尼龙66的路线:

已知:

③A存在顺反异构
根据以上信息回答下列问题:
(1)下列关于有机高分子化合物的说法正确的是________。
A.有机高分子化合物均可水解为小分子
B.淀粉和纤维素的分子式均为(C6H10O5)n,它们互为同分异构体
C.蛋白质的盐析过程是物理变化
D.因蛋白质在高温下易变性,所以疫苗保存时需冷藏
(2)有机物A的结构简式为_______________,A→B的反应类型为___________。
(3)D中所含官能团的名称为_______________________。
(4)写出C+E→F的化学方程式______________。
(5)与E官能团相同的同分异构体有______种(不包括E),写出其中核磁共振氢谱有4组吸收峰且峰面积之比为2:4:1:3的结构简式________________。
(6)已知:

以CH2=CH2为原料,其他无机试剂任选合成 
结合本题信息写出合成路线_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________;
②在工业生产中B气体的大量排放被雨水吸收后形成______而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体.
①A、C的化学式分别是:A________;C________。
② C→D反应的化学方程式 __________________________________;该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
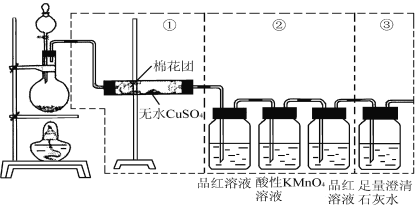
(1)浓硫酸与木炭粉在加热条件下的化学方程式为______________________________。
(2)酸性高锰酸钾溶液的作用是____________;第二个品红溶液的作用是__________________________;说明存在CO2的实验现象是______________________________________________ 。
(3)如果装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检验出的物质是___________;不能检出的物质是____________。
(4)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是_____________;不能检出的物质是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活,汽车尾气所排放的氮氧化物及燃煤所排放的硫氧化物是造成雾霾的重要原因。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:

① 由图1可知,SCR技术中的氧化剂为__________________。
已知c(NO2)∶c(NO)=1∶1时脱氮效果最佳,若生成1molN2时反应放出的热量为QkJ。此时对应的脱氮反应的热化学方程式为___________________。
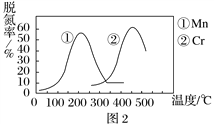
② 图2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为________________。
(2)改善能源结构是治理雾霾问题的最直接有效途径。二甲醚是一种清洁能源,可用合成气在催化剂存在下制备二甲醚,其反应原理为:2CO(g)+4H2(g)![]() CH3OCH3 (g)+H2O(g) ΔH
CH3OCH3 (g)+H2O(g) ΔH
已知在一定条件下,该反应中CO的平衡转化率α随温度、投料比![]() 的变化曲线如图3所示。
的变化曲线如图3所示。

① a、b、c按由大到小的顺序排序为____;ΔH__0(填“>”“<”或“=”)。
② 对于气相反应,用某组分(B)的平衡分压p(B)代替物质的量浓度c(B)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=_______。
③ 在恒容密闭容器里按体积比为1∶2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是_____。
A. 一氧化碳的转化率减小
B. 容器的压强增大
C. 化学平衡常数K值减小
D. 逆反应速率先增大后减小
E. 混合气体的密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷燃料电池的化学反应为CH4+ 2O2= CO2+ 2H2O,其中1个电极反应式为
2O2+ 8H4+ 8e-= 4H2O下列叙述不正确的是( )
A. CH4通入负极
B. O2通入正极
C. 正极发生氧化反应
D. 负极的电极反应式为:CH4+ 2H2O– 8e-= CO2+ 8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,则下列说法不正确的是( )
A. 常温常压下,6克水中所含的原子数为NA
B. 标准状态下,11.2L乙醇所含的分子数目为0.5NA
C. 2.3克金属钠完全变为钠离子时失去的电子数为0.2NA
D. 0.2mol/L的BaCl2溶液中氯离子的个数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com