
【题目】一定量的铁、铝合金与300mL 2mol/L硝酸完全反应生成3.36LNO(标况)和三价铁盐、铝盐等,再向反应后的溶液中加入3mol/L的NaOH溶液,使铝、铁元素完全沉淀下来,则所加NaOH溶液的体积是( )
A. 450mL B. 150mL C. 200mL D. 无法计算
【答案】B
【解析】
硝酸的物质的量为:0.3L×2mol/L=0.6mol,生成NO的物质的量为:![]() =0.15mol,根据质量守恒以及反应后溶液的溶质为NaNO3进行计算。
=0.15mol,根据质量守恒以及反应后溶液的溶质为NaNO3进行计算。
硝酸的物质的量为:0.3L×2mol/L=0.6mol,生成NO的物质的量为:![]() =0.15mol,所以反应后的溶液中NO3-的物质的量为0.6mol-0.15mol=0.45mol,再向反应后的溶液中加入 3mol/L的NaOH 溶液,使铝、铁元素恰好全部转化为沉淀,则反应后溶液的溶质成分为NaNO3,由质量守恒可知n(NaOH)=n(NaNO3)=n(NO3-)=0.45mol,则所加 NaOH 溶液的体积V(NaOH)=
=0.15mol,所以反应后的溶液中NO3-的物质的量为0.6mol-0.15mol=0.45mol,再向反应后的溶液中加入 3mol/L的NaOH 溶液,使铝、铁元素恰好全部转化为沉淀,则反应后溶液的溶质成分为NaNO3,由质量守恒可知n(NaOH)=n(NaNO3)=n(NO3-)=0.45mol,则所加 NaOH 溶液的体积V(NaOH)=![]() =
=![]() =0.15L=150mL,答案选B。
=0.15L=150mL,答案选B。


科目:高中化学 来源: 题型:
【题目】某兴趣小组为探究难溶性盐X(仅含三种元素)的组成和性质,设计并完成如下实验:
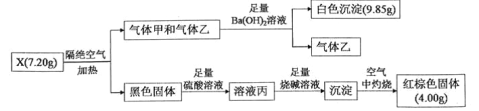
已知:气体甲和气体乙组成元素相同,物质的量之比为1:1。请回答:
(1)X的化学式为___________。
(2)溶液丙与H2O2溶液在酸性条件下反应的离子方程式是___________________________。
(3)写出利用流程图中某种物质将红棕色固体重新转化为黑色固体的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 电子云图中的小黑点密表示该核外空间的电子多
B. 电子排布式 1s22s22px2违反了洪特规则
C. 原子序数为7、8、9的三种元素,其第一电离能和电负性均依次增大
D. 元素周期表中Fe处于ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验:
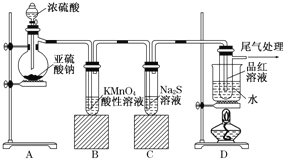
(1)装置A中盛放亚硫酸钠的仪器名称是_________,其中发生反应的化学方程式为_______。
(2)实验过程中,装置B、C中发生的现象分别是______、______,装置B中发生反应的离子方程式为_____。
(3)设计装置D的目的是________。
(4)最后用某溶液进行尾气处理,反应的离子方程式为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为密闭容器中反应C(s)+H2O(g)![]() CO(g)+H2(g) ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
CO(g)+H2(g) ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
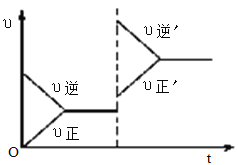
A. 起始反应物为CO和H2
B. 改变条件后平衡逆向移动
C. 新平衡时CO的浓度比原平衡小
D. 改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性氧化锌是一种多功能性的新型无机材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
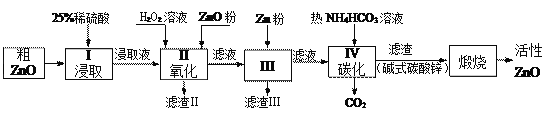
已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空:
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要_____(选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤II中加入H2O2溶液的作用是_________________________(用离子方程式表示);
(3)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是_______________________。
(4)步骤III中加入Zn粉的作用是:①__________________;②进一步调节溶液pH。
(5)碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为________________________________。
(6)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
① 取1.000g活性氧化锌,用15.00mL 1.000mol·L-1 硫酸溶液完全溶解,滴入几滴甲基橙。② 用浓度为0.5000mol·L-1 的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的方法是________;所得活性氧化锌的纯度为________(相对原子质量 O-16 Zn-65 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2004年4月15日,重庆某化工厂氯气泄露并发生爆炸,爆炸现场弥漫着黄色烟雾,这起事故共造成7人丧生,并致使近15万群众紧急疏散。问题:
(1)爆炸现场弥漫的黄色烟雾,除氯气外,形成雾的主要原因是Cl2与水反应,反应的化学方程式为___________________________________;形成烟的成分包含Cl2与Fe反应的产物___________,Cl2是一种有毒气体,为消除毒气,消防部门用消防用水与碱液在外围50米处形成两道水幕进行稀释,写出Cl2与强碱溶液反应的离子方程式__________________________________。
(2)Cl2及其无机产品常用做消毒剂,如“84消毒液”(NaClO)、“漂白粉”等,它们的消毒原理都是在潮湿的空气中与CO2和水蒸气反应生成了次氯酸,请写出“84消毒液”(NaClO)在空气中发生作用的化学方程式:________________________________。
(3)用氯气对饮用水消毒已经有百年的历史,这种消毒的方法中氯气会与水中的有机物发生氯代生成对人体有害的的氯代物,于是世界环保联盟建议推广广谱高效消毒剂二氧化氯(ClO2),制取二氧化氯的其中一种方法是:Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O,该反应中氧化剂是_______,还原剂是_______,氧化剂与还原剂的物质的量之比为_________;若生成1mol ClO2则转移电子数为____________(NA表示阿伏伽德罗常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com