
分析 (1)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(2)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(3)氯气氧化性强于碘,能够置换碘,碘易溶于四氯化碳,显紫红色;依据分液的正确操作解答;
(4)碘、四氯化碳相互溶解,二者沸点不同,选择蒸馏分离;
依据碘化钾溶液含碘化钾的物质的量计算制取的碘的质量,然后计算萃取率.
解答 解:(1)配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶,故正确的操作顺序:B、C、A、F、E、D,
故答案为:B、C、A、F、E、D;
(2)A、配制前,容量瓶中有少量蒸馏水,对溶质的物质的量和溶液的体积不会产生影响,溶液的浓度不变故A不选;
B、加蒸馏水时不慎超过了刻度线,导致溶液的体积偏大,溶液的浓度偏低,故不选;
C、定容时俯视刻度线,导致溶液的体积偏小,溶液的浓度偏低,故选;
D、向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面,导致溶质的物质的量偏小,溶液的浓度偏低,故不选;
故选:C;
(3)氯气的氧化性强于碘,所以向上述所得KI溶液通入足量Cl2充分发生反应:2KI+Cl2═I2+2KCl得到I2的水溶液,再向其中加入CCl4萃取I2.待液体分层后下层溶液为:紫红色;得到下层溶液的操作是:待液体分层后,将分液漏斗颈上的玻璃塞打开,或使塞上的凹槽(或小孔)对准漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下;
故答案为:紫红;待液体分层后,将分液漏斗颈上的玻璃塞打开,或使塞上的凹槽(或小孔)对准漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下;
(4)碘、四氯化碳相互溶解,二者沸点不同,选择蒸馏分离;250ml 1mol/L KI溶液含有碘化钾的物质的量=0.25L×1mol/L=0.25mol,依据方程式:2KI+Cl2═I2+2KCl可知生成碘0.125mol,质量为:0.125mol×254g/mol=31.75g,所以萃取率$\frac{31.0}{31.75}$×100%=97.6%,
故答案为:97.6%.
点评 本题考查了一定物质的量浓度溶液的配制,萃取实验的操作,题目难度不大,熟悉相关知识是解题关键.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A.烟花的颜色 | B.贴春联 | C.鞭炮的燃放 | D.包饺子 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
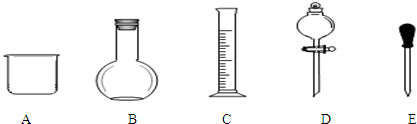
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
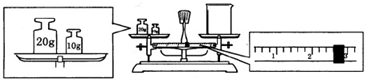
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g.mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.32 | 158 |
| 氯化钠 | 0.08 | 58.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
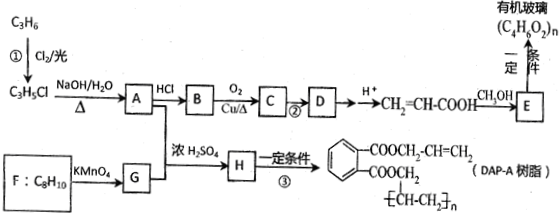
 ;
;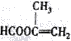 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com