
【题目】用琥珀酸酐法制备了DEN人工抗原及抗体.如图是1,3﹣丁二烯合成琥珀酸酐的流程:
1,3丁二烯![]() C4H6Br2
C4H6Br2![]() A
A![]() B
B![]() C
C![]()

完成下列填空:
(1)写出反应试剂和反应条件.反应①______;反应②______.
(2)比1,3﹣丁二烯多一个C并且含1个甲基的同系物有______种.
(3)写出A和C的结构简式.A______;C______.
(4)写出B和C反应生成高分子化合物的化学方程式______.
(5)设计一条由1,3﹣丁二烯为原料制备![]() 的合成路线.(无机试剂可以任选)_____
的合成路线.(无机试剂可以任选)_____
(合成路线常用的表示方式为:A![]() B…
B…![]() 目标产物)
目标产物)
【答案】溴水或溴的四氯化碳溶液 氢气、催化剂、加热 2 BrCH2CH2CH2CH2Br HOOCCH2CH2COOH nHOCH2CH2CH2CH2OH+nHOOCCH2CH2COOH![]()
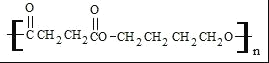 +2nH2O 1,3丁二烯
+2nH2O 1,3丁二烯![]() BrCH2CH=CHCH2Br
BrCH2CH=CHCH2Br![]() HOCH2CH=CHCH2OH
HOCH2CH=CHCH2OH![]()
![]()
![]()
![]()
![]() NaOOCCH=CHCOONa
NaOOCCH=CHCOONa![]() HOOCCH=CHCOOH
HOOCCH=CHCOOH![]()
![]()
![]()
![]()
【解析】
根据各物质的转化关系结合分子式C4H6Br2,可知1,3﹣丁二烯与溴发生1,4﹣加成,得C4H6Br2为 BrCH2CH2CH2CH2Br,与氢气加成得A为BrCH2CH2CH2CH2Br,A发生碱性水解得B为HOCH2CH2CH2CH2OH,B发生催化氧化得C为HOOCCH2CH2COOH,C发生分子内脱水得琥珀酸酐,由1,3﹣丁二烯为原料制备![]() ,可以用与溴发生1,4﹣加成再碱性水解得HOCH2CH=CHCH2OH,用HOCH2CH=CHCH2OH与溴化氢加成得HOCH2CH2CHBrCH2OH,再将HOCH2CH2CHBrCH2OH氧化成HOOCCH2CHBrCOOH,将在氢氧化钠醇溶液中发生消去反应得NaOOCCH=CHCOONa,酸化后再分子脱水形成酸酐再发生加聚反应得产品,据此答题。
,可以用与溴发生1,4﹣加成再碱性水解得HOCH2CH=CHCH2OH,用HOCH2CH=CHCH2OH与溴化氢加成得HOCH2CH2CHBrCH2OH,再将HOCH2CH2CHBrCH2OH氧化成HOOCCH2CHBrCOOH,将在氢氧化钠醇溶液中发生消去反应得NaOOCCH=CHCOONa,酸化后再分子脱水形成酸酐再发生加聚反应得产品,据此答题。
(1)根据上面的分析可知,反应①的试剂和反应条件为水或溴的四氯化碳溶液,反应②的试剂和反应条件为氢气,催化剂,加热;
(2)比1,3﹣丁二烯多一个C并且含1个甲基的同系物为CH2=CH2CH=CHCH3、CH2=CH2C(CH3)=CH2,所以有2种;
(3)根据上面的分析可知,A为BrCH2CH2CH2CH2Br,C为HOOCCH2CH2COOH;
(4)丁二酸和丁二醇发生缩聚反应生成高分子化合物,反应的化学方程式为nHOCH2![]()
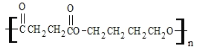 +2nH2O;
+2nH2O;
(5)由1,3﹣丁二烯为原料制备![]() ,可以用与溴发生1,4﹣加成再碱性水解得HOCH2CH=CHCH2OH,用HOCH2CH=CHCH2OH与溴化氢加成得HOCH2CH2CHBrCH2OH,再将HOCH2CH2CHBrCH2OH氧化成HOOCCH2CHBrCOOH,将在氢氧化钠醇溶液中发生消去反应得NaOOCCH=CHCOONa,酸化后再分子脱水形成酸酐再发生加聚反应得产品,合成路线为
,可以用与溴发生1,4﹣加成再碱性水解得HOCH2CH=CHCH2OH,用HOCH2CH=CHCH2OH与溴化氢加成得HOCH2CH2CHBrCH2OH,再将HOCH2CH2CHBrCH2OH氧化成HOOCCH2CHBrCOOH,将在氢氧化钠醇溶液中发生消去反应得NaOOCCH=CHCOONa,酸化后再分子脱水形成酸酐再发生加聚反应得产品,合成路线为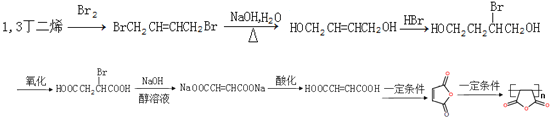 。
。


科目:高中化学 来源: 题型:
【题目】绿色植物的光合作用,是地球表面上最普遍的化学变化,也是将___________能转化为________ 能的最主要途径。植物通过光合作用,将二氧化碳和水转化为葡萄糖(C6H12O6),并放出氧气,请写出该反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景. PPG的一种合成路线如下:
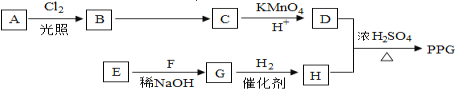
已知:
①烃A的相对分子质量为70,其一氯代物只有一种。
②化合物B为一氯代烃,化合物C的分子式为C5H8。
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质。
④R1CHO+R2CH2CHO
⑤R1CH2=CH2R2 →R1COOH+R2COOH
回答下列问题:
(1)A的结构简式为________________________________。
(2)B到C的反应条件________________________________。
(3)由E和F生成G的化学方程式为________________________,反应类型_________。
(4)由D和H生成PPG的化学方程式为___________________。
(5)写出D的最简同系物和H按1:1反应的产物______________________。
(6)写出G和新制的氢氧化铜溶液反应的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)是一种绿色环保的还原剂,其氧化产物为氮气。
(1) 合成联氨的有关反应如下:
NH3(g)+NaClO(aq)=NH2Cl(l)+NaOH(aq) ΔH1=-67.45 kJ·mol-1
NH2Cl(l)+NaOH(aq)+NH3(g)=N2H4(l)+NaCl(aq)+H2O(l) ΔH2=-195.32 kJ·mol-1
反应2NH3(g)+NaClO(aq)=N2H4(l)+NaCl(aq)+H2O(l) ΔH=________kJ·mol-1。
(2) 联氨为二元弱碱,在水中的电离方式与氨相似,写出联氨与过量盐酸反应的离子方程式:________。
(3) 联氨—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是__________。
(4) 若用此碱性燃料电池作电源,电解AgNO3溶液,电解方程式为_________;若阴极析出5.40g金属银,则联氨—空气燃料电池中至少通入标准状况下空气体积________mL(假设空气中氧气体积分数为20%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在如下平衡:NH3+H2O ![]() NH3·H2O
NH3·H2O![]() NH4+ + OH-,下列向稀氨水中加入下列物质时的描述错误的是( )
NH4+ + OH-,下列向稀氨水中加入下列物质时的描述错误的是( )
A.加入氯化铵固体,平衡逆向移动,溶液pH降低
B.通入更多氨气,平衡正向移动,溶液碱性增强
C.加入氢氧化钠固体,平衡逆向移动,溶液导电性增强
D.加入适量 NaCl溶液,平衡不移动,溶液pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸的工业制备包括氨的合成、氨的催化氧化及硝酸的浓缩等过程.完成下列计算:
(1)采用甲烷的二次转化法可以制备氢气.
第一次转化的化学方程式:CH4+H2O→CO+3H2;
第二次转化的化学方程式:2CO+CH4+2O2→3CO2+2H2;2CO+O2→2CO2.
现有标准状况下1m3的甲烷,若第一次转化80%,第二次转化20%,经过二次完全转化后可以得到H2__mol.
(2)用饱和K2CO3溶液吸收上述混合气体中的CO2以得到纯净的氢气.处理上述的CO2至少需要饱和K2CO3溶液____g.(已知:20℃K2CO3溶解度:110g/100g水)
(3)已知NH3+2O2→HNO3+H2O.现有氨气1.7吨,不补充水,理论上可制得硝酸的浓度为___%;在该硝酸中加入__吨水最终可得50%的硝酸.
(4)工业上常用98%的浓H2SO4作为制取浓HNO3的脱水剂.63.5%HNO3(质量为M1)中加98%的浓H2SO4(质量为M2)后蒸馏.分别得到97.7%的HNO3和49%的H2SO4溶液(不含HNO3).
①若蒸馏过程中HNO3、H2SO4、H2O均无损耗,求蒸馏前的投料比![]() 的值__(列式计算).
的值__(列式计算).
②蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(M1+M2)×5.0%的H2O流失.则投料时,![]() 比值如何变化,请列式计算说明__.
比值如何变化,请列式计算说明__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KBBF 品体[氟代硼铍酸钾(KBe2BO3F2)]是用于制造深紫外激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)基态F原子中能量最高的电子其电子云轮廓图为_______形;基态K原子的核外电子排布式为______。
(2)氮与氧均为第二周期元素,请判断N元素与O元素的第一电离能I1(N)_____I1(O)(填"大于"“小于”或“等于”),原因是_____________。
(3)H3BO3是一种一元弱酸,可与NaOH 溶液反应生成Na[B(OH)4],在硼酸和B(OH)4—中B原子的杂化方式分别为________。
(4)BF3是一种 _________分子(填写“极性”或“非极性”),BF3分子的空间构型为____________,与BF3互为等电子体的分子或离子有________(写出一种即可)。
(5)周期表中,某些主族元素的左上或右下元素的性质是相似的,被称为对角线规则。写出Be元素最高价氧化物的水化物与NaOH溶液反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com