
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
科目:高中化学 来源: 题型:
【题目】肼(N2H4)/空气燃料电池的能量转化率高,装置如图所示。电池放电时,电流由铜极经外电路流向铂极。下列说法错误的是( )

A.在铜极区填充空气
B.放电过程中,OH-向铂极迁移
C.负极反应式为N2H4—4e-=N2+4H+
D.放电过程中,铂极附近溶液pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】理解和应用信息在有机合成中具有重要作用,请依据下列信息回答问题:
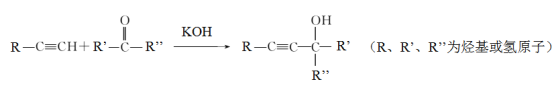
(1)该反应类型为_______________
(2)下列物质能发生上述反应的是______
A.![]() 与
与![]()
B.![]() 与HCHO
与HCHO
C.![]() 与
与![]()
(3)![]() 和
和![]() 在上述条件下能够合成分子式为C8H14O2的物质,该物质的结构简式为________________
在上述条件下能够合成分子式为C8H14O2的物质,该物质的结构简式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是一种天然抗氧化剂,具有较强的抗氧化活性,能有效降低癌症和动脉硬化的风险。其结构简式为:
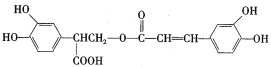
合成路线如下:
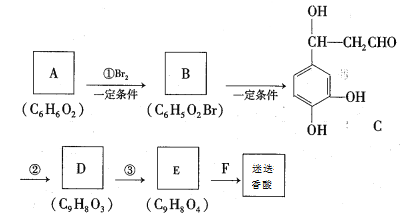
根据题意回答下列问题:
(1)A的结构简式为____________。
(2)①、②的反应类型分别是_____________、_____________。
(3)E的结构简式为__________________
(4)F在一定条件下发生缩聚反应的化学方程式为__________________________________
(5)写出一种与C互为同分异构体,且同时满足下列条件的有机的结构简式________________
①苯环上的一氯代物有2种
②1 mol该有机物能与1 molNaHCO3反应
③能与浓溴水反应,1 mol该有机物消耗3 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮氧化物是形成光化学烟雾和酸雨的一个重要原因,用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:![]() △H=-1160kJ·mol-1
△H=-1160kJ·mol-1
![]() △H=+293kJ·mol-1
△H=+293kJ·mol-1
则该条件下,CH4催化还原NO2消除污染的热化学方程式为________________________。
(2)乙炔(CH≡CH)是重要的化工原料。工业上可用甲烷裂解法制取乙炔:![]() 同时发生副反应:
同时发生副反应:![]() ;甲烷裂解时,几种气体平衡时分压(Pa)的对数即lgP与温度(℃)之间的关系如图所示。根据图判断,反应
;甲烷裂解时,几种气体平衡时分压(Pa)的对数即lgP与温度(℃)之间的关系如图所示。根据图判断,反应![]() △H___0(填“>”或“<”)。
△H___0(填“>”或“<”)。

1725℃时,向恒容密闭容器中充入CH4,达到平衡时CH4生成C2H2的平衡转化率为_____。该温度下,![]() 的平衡常数Kp=_______[注:用平衡分压(Pa)代替平衡浓度(mol·L-1)进行计算]。
的平衡常数Kp=_______[注:用平衡分压(Pa)代替平衡浓度(mol·L-1)进行计算]。

(3)利用在特定条件下用铂电极(阳极为铂丝)电解饱和硫酸氢钾溶液的方法制备K2S2O8(过二硫酸钾)。在低温下电解液中主要含有K+、H+和![]() 离子,电流通过溶液后发生反应。阳极区电极反应式为______________________________,X为_________交换膜(填“质子”、“阳离子”或“阴离子”),当电路中通过0.2mol e-时,两边溶液质量的变化差为_________。
离子,电流通过溶液后发生反应。阳极区电极反应式为______________________________,X为_________交换膜(填“质子”、“阳离子”或“阴离子”),当电路中通过0.2mol e-时,两边溶液质量的变化差为_________。
(4)甲烷燃料电池采用铂为电极,两电极上分别通入CH4和O2,电解质溶液为300mL 1.0mol·L-1的NaOH溶液。当O2通入量为8.96L(标准状况)且反应完全时,所得溶液中各离子浓度由大到小的顺序为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将6体积的NO2(不考虑N2O4)和一定体积的NO置于试管中,并将试管倒置于水中,当通入4.5体积的O2充分反应后,剩余1.5体积气体,则原NO体积可能为( )
①3体积 ②4体积 ③5体积 ④5.5体积 ⑤2体积
A.③B.⑤C.④或⑤D.②或⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,盛有PbO2的圆底烧瓶中滴加浓盐酸,产生黄绿色气体,其反应的化学方程式为_______。
(2)以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
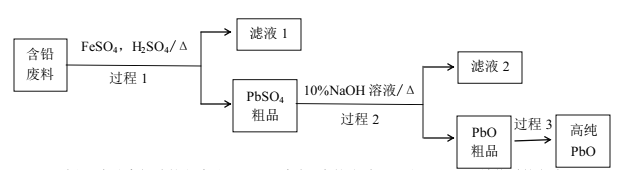
过程1中分离提纯的方法是___,滤液2中的溶质主要是____填物质的名称)。过程1中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是_______。
(3)将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
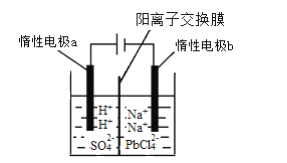
①写出电解时阴极的电极反应式_________。
②电解过程中通过阳离子交换膜的离子主要为____。
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向____极室(填“阴”或者“阳”)加入____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,在3支相同体积的试管中分别充有等体积混合的两种气体,它们是①NO和NO2,②NO2和O2,③NO和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3B.V1>V3>V2
C.V2>V3>V1D.V3>V1>V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成药物查尔酮类抑制剂的中间体,可由X在一定条件下反应制得:

下列叙述正确的是( )
A. 反应过程中加入K2CO3,能提高X的转化率
B. Y与Br2的加成产物分子中不含手性碳原子
C. X和Y均能与新制的Cu(OH)2在加热条件下反应生成砖红色沉淀
D. 等物质的量的X、Y分别与H2反应,最多消耗H2的物质的量之比为3∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com