
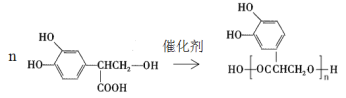
����Ŀ���Ե�������һ����Ȼ�������������н�ǿ�Ŀ��������ԣ�����Ч���Ͱ�֢�Ͷ���Ӳ���ķ��ա���ṹ��ʽΪ��
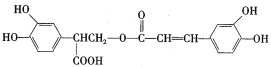
�ϳ�·�����£�
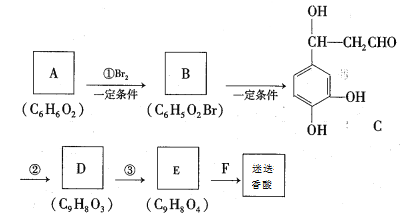
��������ش��������⣺
(1)A�Ľṹ��ʽΪ____________��
(2)�����ڵķ�Ӧ���ͷֱ���_____________��_____________��
(3)E�Ľṹ��ʽΪ__________________
(4)F��һ�������·������۷�Ӧ�Ļ�ѧ����ʽΪ__________________________________
(5)д��һ����C��Ϊͬ���칹�壬��ͬʱ���������������л��Ľṹ��ʽ________________
�ٱ����ϵ�һ�ȴ�����2��
��1 mol���л�������1 molNaHCO3��Ӧ
������Ũ��ˮ��Ӧ��1 mol���л�������3 mol Br2
���𰸡�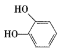 ȡ����Ӧ ��ȥ��Ӧ
ȡ����Ӧ ��ȥ��Ӧ 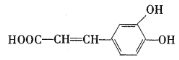
��������
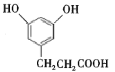
��������ͼ��A��һ�����������巴Ӧ����B����ԭ���������ԭ�ӣ�����ȡ����Ӧ�����C�Ľṹ��֪��AΪ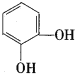 ��BΪ
��BΪ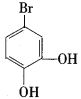 ��C�Ļ�ѧʽΪC9H10O4��ת��ΪD������H2O����˷�Ӧ��Ϊ��ȥ��Ӧ����DΪ
��C�Ļ�ѧʽΪC9H10O4��ת��ΪD������H2O����˷�Ӧ��Ϊ��ȥ��Ӧ����DΪ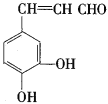 ��ת��ΪE��������1��Oԭ�ӣ���Ӧ��Ϊ������Ӧ��EΪ
��ת��ΪE��������1��Oԭ�ӣ���Ӧ��Ϊ������Ӧ��EΪ ������Ե�����(
������Ե�����(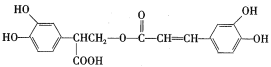 )�Ľṹ��֪��FΪ
)�Ľṹ��֪��FΪ ���ݴ˷������
���ݴ˷������
(1)��������������A�Ľṹ��ʽΪ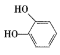 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(2)����������������Ӧ��Ϊȡ����Ӧ����Ӧ��Ϊ��ȥ��Ӧ���ʴ�Ϊ��ȡ����Ӧ����ȥ��Ӧ��
(3)��������������E�Ľṹ��ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(4)FΪ �������к����ǻ����Ȼ�����һ�������·������۷�Ӧ�Ļ�ѧ����ʽΪn
�������к����ǻ����Ȼ�����һ�������·������۷�Ӧ�Ļ�ѧ����ʽΪn
![]()
 + (n-1)H2O���ʴ�Ϊ��n
+ (n-1)H2O���ʴ�Ϊ��n
![]()
 + (n-1)H2O��
+ (n-1)H2O��
(5)CΪ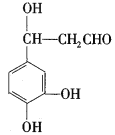 ����ѧʽΪC9H10O4���ٱ����ϵ�һ�ȴ�����2����˵�����нϺõĶԳƽṹ����1 mol���л�������1 molNaHCO3��Ӧ��˵���ṹ�к���1���Ȼ������ݲ����Ͷȿ�֪���ṹ�в��ܳ���̼̼˫���Ȳ����ͽṹ������Ҫ����2���ǻ������Ѽ�����������Ũ��ˮ��Ӧ��˵���ṹ�к��з��ǻ���1 mol���л�������3 mol Br2����Ҫ2���ǻ�λ�ڼ�λ������һ������Ҳλ�ڼ�λ������������ͬ���칹��Ϊ
����ѧʽΪC9H10O4���ٱ����ϵ�һ�ȴ�����2����˵�����нϺõĶԳƽṹ����1 mol���л�������1 molNaHCO3��Ӧ��˵���ṹ�к���1���Ȼ������ݲ����Ͷȿ�֪���ṹ�в��ܳ���̼̼˫���Ȳ����ͽṹ������Ҫ����2���ǻ������Ѽ�����������Ũ��ˮ��Ӧ��˵���ṹ�к��з��ǻ���1 mol���л�������3 mol Br2����Ҫ2���ǻ�λ�ڼ�λ������һ������Ҳλ�ڼ�λ������������ͬ���칹��Ϊ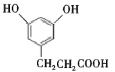 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����²���������ʵĵ���ƽ�ⳣ�����±���
��ѧʽ | HF | HClO | H2CO3 | NH3��H2O |
���볣�� | 6.8��104 | 4.7��108 | K1=4.3��107 K2=5.6��1011 | Kb=1.7��105 |
(1)�����£����ʵ����ܶ���ͬ��������Һ��NaF��Һ ��NaClO��Һ ��Na2CO3��Һ����PH�ɴ�С��˳����___________(�����)
(2)25��Cʱ��PH=4��NH4Cl��Һ�и�����Ũ�ȵĴ�С��ϵΪ___________________
(3)NaClO��Һ�еĵ���غ��ϵΪ_________________
(4)��NaClO��Һ��ͨ��������CO2�������������ӷ���ʽΪ_________
(5)�����£�0.1mol/L�İ�ˮ��0.1mol/L��NH4Cl��Һ�������ϣ��жϻ����Һ�������____________(��������������������������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��˳������ѧ����Ϊ˳���ȶ����ϲ�(II)����ѧʽΪPtCl2(NH3)2����Է�������Ϊ��300����һ���������ư�֢��ҩ�һƬ˳��ҩƬ����˳��������Ϊ6��10-4g����ôһƬ˳��ҩƬ��Nԭ�ӵ����ʵ���___mol��
��2����ϩ���壨C2H4����ʯ�ͻ�����Ʒ֮һ��Ҳ������Ҫ���л���������ԭ��֮һ���ڱ�״�������ܶ�Ϊ___gL-1��
��3������һ�ֿ�Ȫˮ��Ʒ��1.0L�ĸÿ�Ȫˮ����4.8��10-2gMg2+����___L��Ȫˮ�к���1mol Mg2+��
��4��ij��84����Һ��1000mL������Ч�ɷ�ΪNaClO(ʽ����74.5)����������Ϊ14.9�����ܶ�Ϊ1.2g/mL�������ʵ����ʵ���Ũ��Ϊ___molL��1��
��5����֪CO��CO2�Ļ������7.2g���ڱ�״������ռ�����Ϊ4.48L����û����������Ԫ�ص�����Ϊ___g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ֽ�200mL0.30mol/L��������50mL0.80mol/LCaCl2��Һ���(��Ϻ�����仯���Բ���)��������Һ��Cl�������ʵ���Ũ����___��
��2����20.0g�������ƹ�������ˮ���100mL��Һ�����ܶ�Ϊ1.25g��mL��1������Һ���������Ƶ����ʵ���Ũ��Ϊ___����������Ϊ___���Ӹ���Һ��ȡ��10 mL�������ˮϡ�͵�100 mL��ϡ�ͺ���Һ���������Ƶ����ʵ���Ũ��Ϊ___����һ�������ԭ��Һ��ϡ�ͺ����Һ��1��4������Ȼ�ϣ����Ի��ʱ��Һ����仯�������û����Һ���������Ƶ����ʵ���Ũ��Ϊ___��
��3�����廯����A����ʽ�ɱ�ʾΪOxFy����֪ͬ��ͬѹ��10mLA���ȷֽ�����15mLO2��10mLF2����A�Ļ�ѧʽΪ___���ƶϵ�����Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�о��Ͼɵ�ص������ã�ʵ�������þɵ�ص�ͭñ(��Ҫ�ɷ�ΪZn��Cu)����Cu���Ʊ�ZnO�IJ���ʵ�������ͼ��ʾ�����������������

A. ���ܽ�����������Һ�¶Ȳ��˹���
B. ͭñ�ܽ����Һ�����������Գ�ȥ��Һ�й�����������H2O2
C. ��п�۷�Ӧ�����ӿ���ΪCu2+��H+
D. ����������������Һ�����ᾧ�����ˡ�ϴ�ӡ�����������ռ��ɵô�����ZnO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaNO2)��һ�ֳ��õ�ʳƷ���Ӽ���ʹ��ʱ���ϸ����������ʵ������2NO+Na2O2=2NaNO2Ϊԭ������������װ����ȡNaNO2(�гֺͼ���������)��

��֪��������KMnO4��Һ�ɽ�NO��NO2-����ΪNO3-��MnO4-����ԭΪMn2+��
��HNO2���в��ȶ��ԣ�2HNO2=NO2��+NO��+H2O��
�ش��������⣺
(1)�������������������ӿ�______________(��ӿ���ĸ)��
(2)ʵ�������Cװ���ڹ۲쵽��������___________________________��
(3)Na2O2��ַ�Ӧ�ⶨNaNO2��������ȡ��Ӧ��B�й�����Ʒ3.45g��������ˮ����ȴ����0.50mol�� L-1����KMnO4��Һ�ζ����ظ����Σ���Һƽ������Ϊ20.00mL��
�ٸòⶨʵ����Ҫ�õ����������е�___________(�����)��
a����ƿ b������ƿ c����ͷ�ι� d����ʽ�ζ��� e����ʽ�ζ��� f��������
�ڼٶ��������ʲ���KMnO4��Ӧ���������Ʒ��NaNO2�Ĵ���Ϊ____����
��ʵ��õ�NaNO2�ĺ�������ƫ�ͣ�������Ʒ�к��е���Ҫ����Ϊ_____(�ѧʽ)��Ϊ��߲�Ʒ��������ʵ��װ�õĸĽ�����Bװ��֮ǰ��װʢ��_____(��ҩƷ����)��______(����������)��
(4)���һ��ʵ�鷽��֤������������NaNO2����������________________________��
(�ṩ���Լ���0.10mol��L-1NaNO2��Һ��KMnO4��Һ��0.10mol��L-1KI��Һ��������Һ��ϡ���ᡢϡ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ե��з�̪��Һ��������Һ����������ɫ�������
A. ������Һ���� B. CH3COONa��Һ����
C. ��ˮ�м�������NH4Cl���� D. С�մ���Һ�м�������NaCl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�����仯��������Ҫ�ĺϽ���Ϻʹ�������ش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ_____���Ų�ʱ������ߵĵ�����ռ�ܼ���ԭ�ӹ����____����չ����
��2�������γɶ�������������������ε�Ni(CO)4 �������ε�[Ni(CN)4]2-�����������ε�[Ni(NH3)6]2+�ȡ�����˵����ȷ����___
A��CO��CN-��Ϊ�ȵ����壬����CO��������������������֮��Ϊ1:2-
B��NH3�Ŀռ乹��Ϊƽ��������
C��Ni2+���γ������ʱ������λ��ֻ��Ϊ4
D��Ni(CO)4��[Ni(CN)4]2-�У���Ԫ�ؾ���sp3�ӻ�
��3������ͪ뿳����ڼ���Ni2+����ϡ��ˮ�У�����ͪ���Ni2+��Ӧ�����ʺ�ɫ��������ṹ��ͼ��ʾ���ýṹ�У������ۼ��������λ�������������ͼ�����������������ֱ��ʾ����λ���������_____
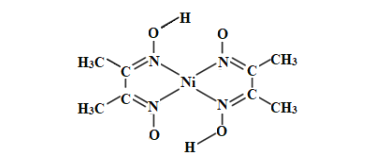
��4��NiO�ľ���ṹ�������Ȼ��Ƶ���ͬ��������Ӱ뾶���±���
![]()
NiO������Ni2+����λ��Ϊ____��NiO�۵��NaCl�ߵ�ԭ����_____��
��5���о����������Ͻ�LaNix��һ�����õĴ�����ϡ���������ϵ,�侧����ͼa��ʵ����ʾ������λ�������֣��ֱ��ǰ������϶����![]() �������������϶����
�������������϶����![]() ��������ͼb��c����Щ������ԭ�Ӵ洢��������ʱ�����仯ѧʽΪLaNixHy��
��������ͼb��c����Щ������ԭ�Ӵ洢��������ʱ�����仯ѧʽΪLaNixHy��
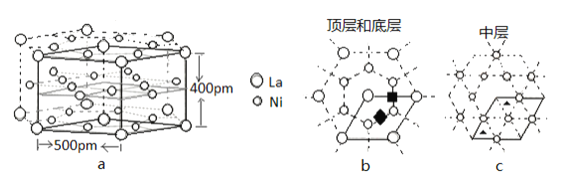
��LaNix�Ͻ���x��ֵΪ_____��
�ھ����к���![]() ��ͬ��İ������϶��___��������
��ͬ��İ������϶��___��������![]() ��ͬ����������϶��___����
��ͬ����������϶��___����
����H���뾧��������������䣬H������ܶ���______g/cm-3������2λ��Ч���֣�NA=6.0��1023��![]() =1.7��
=1.7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦA+3B![]() 2C+2D��4�ֲ�ͬ�����µķ�Ӧ����(��λΪmol��L-1��s-1)�ֱ�Ϊ��v(A)=0.15 ��v(B)=0.6 ��v(C)=0.4 ��v(D)=0.45�÷�Ӧ��Ӧ��������������( )
2C+2D��4�ֲ�ͬ�����µķ�Ӧ����(��λΪmol��L-1��s-1)�ֱ�Ϊ��v(A)=0.15 ��v(B)=0.6 ��v(C)=0.4 ��v(D)=0.45�÷�Ӧ��Ӧ��������������( )
A. �� B. �� C. �ٺ͢� D. �ں͢�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com