
【题目】已知常温下部分弱电解质的电离平衡常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×104 | 4.7×108 | K1=4.3×107 K2=5.6×1011 | Kb=1.7×105 |
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其PH由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)NaClO溶液中的电荷守恒关系为_________________
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)
【答案】③>②>① c(Cl-)> c(NH4+) > c(H+)> c(OH-) c(Na+) + c(H+) = c(OH-) +c(ClO-) ClO-+CO2+H2O=HClO+HCO3- 碱性
【解析】
由图表中数据分析可知酸性HF>H2CO3>HClO>HCO3-,对应盐的水解程度则F-< HCO3-<ClO-<CO32-。
(1)酸越弱,对应盐的水解程度越大,溶液的pH越大;
(2)pH=4的NH4Cl溶液,说明水解呈酸性,溶液中c(H+)>c(OH-),根据电荷守恒判断;
(3)NaClO溶液中含有Na+、ClO-、H+、OH-,以此列出电荷守恒关系;
(4)根据碳酸的酸性强于次氯酸,写出反应的离子方程式;
(5)通过计算并比较Kh和Kb的相对大小,判断NH4+的水解程度和NH3·H2O的电离程度的大小来确定溶液的酸碱性。
由图表中数据分析可知酸性HF>H2CO3>HClO>HCO3-,对应盐的水解程度则F-< HCO3-<ClO-<CO32-。
(1)对应盐的水解程度F-< HCO3-<ClO-<CO32-,则常温下,物质的量溶度相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液其pH由大到小的顺序是:③>②>①。
故答案为:③>②>①;
(2)pH=4的NH4Cl溶液,说明水解呈酸性,溶液中c(H+)>c(OH-),由电荷守恒c(H+)+c(NH4+) =c(Cl-)+c(OH-)可知, c(Cl-)>c(NH4+),则有c(Cl-)> c(NH4+) > c(H+)> c(OH-)。
故答案为:c(Cl-)> c(NH4+) > c(H+)> c(OH-) ;
(3)NaClO溶液中,NaClO=Na++ClO-,H2O![]() H++OH-,故电荷守恒关系为c(Na+) + c(H+) = c(OH-) +c(ClO-);
H++OH-,故电荷守恒关系为c(Na+) + c(H+) = c(OH-) +c(ClO-);
故答案为:c(Na+) + c(H+) = c(OH-) +c(ClO-);
(4)因为酸性:H2CO3>HClO>HCO3-,碳酸的酸性强于次氯酸,所以反应的离子方程式为:ClO-+CO2+H2O=HClO+HCO3-。
故答案为:ClO-+CO2+H2O=HClO+HCO3-;
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,通过计算得到溶液酸碱性:由NH3·H2O的电离常数Kb=1.7×105,可得NH4+的水解常数Kh=![]() =
=![]() =5.9×10-10,因为Kh<Kb,说明NH4+的水解程度小于NH3·H2O的电离程度,所以溶液呈碱性。
=5.9×10-10,因为Kh<Kb,说明NH4+的水解程度小于NH3·H2O的电离程度,所以溶液呈碱性。
故答案为:碱性。


科目:高中化学 来源: 题型:
【题目】实验室向 0.783g MnO2 中加入 20mL36.5%(ρ=1.18g/cm3 )浓盐酸后,共热制取 Cl2.反应方程式为:MnO2+4HClMnCl2+Cl2+2H2O,若反应后溶液体积仍为 20mL,则下列说法正确的是( )
A.反应消耗 HCl 物质的量为 0.236mol
B.反应生成 Cl2 气体的体积为 201.6mL
C.若取 2mL 反应后的溶液,加入足量 AgNO3,可产生沉淀 2.87g
D.若取 2mL 反应后的溶液,加入 2.0mol/L 的 NaOH,当沉淀达到最大值时,消耗 NaOH 溶液的体积为10.9mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是
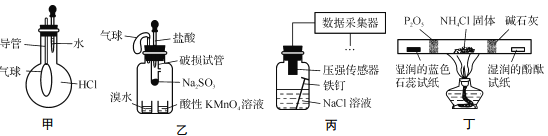
A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是最简单的烃,是一种重要的化工原料。
(1)以甲烷为原料,有两种方法合成甲醇:
方法Ι:①CH4(g)+![]() O2(g)
O2(g)![]() CO(g)+2H2(g) △H1=-35.4kJ/mol
CO(g)+2H2(g) △H1=-35.4kJ/mol
②CO(g)+2H2(g)![]() CH3OH(g) △H2 =-90.1kJ/mol
CH3OH(g) △H2 =-90.1kJ/mol
方法Ⅱ: ③2CH4(g)+O2(g)![]() 2CH3OH(g) △H3 =______kJ/mol
2CH3OH(g) △H3 =______kJ/mol
(2)在密闭容器中充入2molCH4 (g) 和1molO2 (g),在不同条件下反应:2CH4(g)+O2(g)![]() 2CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
2CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。

①P1时升高温度,n(CH3OH)_______________(填“增大”、“减小”或“不变”);
②E、F、N点对应的化学反应速率由大到小的顺序为____________(用V(E)、V(F)、V(N)表示);
③下列能提高CH4平衡转化率的措施是_______________(填序号)
a.选择高效催化剂 b.增大![]() 投料比 c.及时分离产物
投料比 c.及时分离产物
④若F点n (CH3OH)=1mol,总压强为2.5MPa,则T0时F点用分压强代替浓度表示的平衡常数Kp=_____________________ ;
(3)使用新型催化剂进行反应2CH4(g)+O2 (g)![]() 2CH3OH(g)。随温度升高CH3OH的产率如图所示。
2CH3OH(g)。随温度升高CH3OH的产率如图所示。

①CH3OH的产率在T1至T2时很快增大的原因是______________;
②T2后CH3OH产率降低的原因可能是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠常用作漂白剂。某化学小组设计实验制备亚氯酸钠,并进行杂质分析。
实验I 按图装置制备NaC1O2晶体

已知:①C1O2为黄绿色气体,极易与水反应。
②NaC1O2饱和溶液在低于38℃时析出NaC1O2·3H2O晶体,高于38℃时析出NaC1O2晶体,温度高于60℃时NaC1O2分解生成NaC1O3和NaCl。
(1)装置A中b仪器的名称是____;a中能否用稀硫酸代替浓硫酸____(填“能”或“不能”),原因是____。
(2)A中生成C1O2的化学反应方程式为____。
(3)C中生成NaC1O2时H2O2的作用是____;为获得更多的NaC1O2,需在C处添加装置进行改进,措施为____。
(4)反应后,经下列步骤可从C装置的溶液中获得NaC1O2晶体,请补充完善。
i.55℃时蒸发结晶 ii.__________ ii.用40℃热水洗涤 iv.低于60℃干燥,得到成品
实验Ⅱ 样品杂质分析
(5)上述实验中制得的NaC1O2晶体中还可能含有少量中学常见的含硫钠盐,其化学式为____,实验中可减少该杂质产生的操作(或方法)是____(写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲是B元素常见的固体单质,乙常温下呈液态。K是无色气体,是主要大气污染物之一。常温下0.05 mol L -1丙溶液pH为l,上述物质的转化关系如图所示。下列说法正确的是

A. 简单离子半径:C<D<E
B. 元素的非金属性:C>D>E>B
C. 由元素A、C、D仅能组成共价化合物
D. 由元素B、E组成的化合物可用于洗涤试管壁上残余的硫单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)/空气燃料电池的能量转化率高,装置如图所示。电池放电时,电流由铜极经外电路流向铂极。下列说法错误的是( )

A.在铜极区填充空气
B.放电过程中,OH-向铂极迁移
C.负极反应式为N2H4—4e-=N2+4H+
D.放电过程中,铂极附近溶液pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是合成某药物的中间体,其一种合成路线如图:

(1)A中含氧官能团的名称是___。
(2)A→B的反应条件和试剂是___。
(3)D→E的反应类型是___。
(4)写出B→C的化学方程式___。
(5)E的分子式为___。
(6)B的环上二溴代物有___种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是一种天然抗氧化剂,具有较强的抗氧化活性,能有效降低癌症和动脉硬化的风险。其结构简式为:
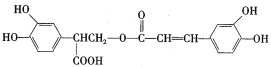
合成路线如下:
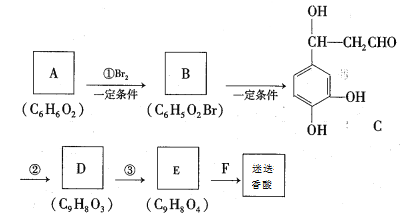
根据题意回答下列问题:
(1)A的结构简式为____________。
(2)①、②的反应类型分别是_____________、_____________。
(3)E的结构简式为__________________
(4)F在一定条件下发生缩聚反应的化学方程式为__________________________________
(5)写出一种与C互为同分异构体,且同时满足下列条件的有机的结构简式________________
①苯环上的一氯代物有2种
②1 mol该有机物能与1 molNaHCO3反应
③能与浓溴水反应,1 mol该有机物消耗3 mol Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com