
【题目】
镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为_____,排布时能量最高的电子所占能级的原子轨道有____个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2-
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数只能为4
D.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化
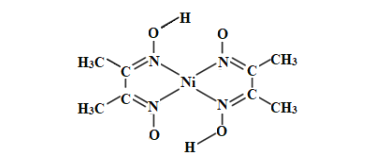
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“”分别表示出配位键和氢键。_____
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
![]()
NiO晶胞中Ni2+的配位数为____,NiO熔点比NaCl高的原因是_____。
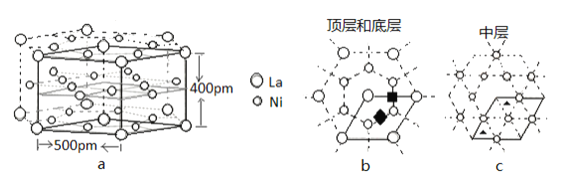
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。属六方晶系,其晶胞如图a中实线所示,储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
①LaNix合金中x的值为_____;
②晶胞中和“![]() ”同类的八面体空隙有___个,和“
”同类的八面体空隙有___个,和“![]() ”同类的四面体空隙有___个。
”同类的四面体空隙有___个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______g/cm-3(保留2位有效数字,NA=6.0×1023,![]() =1.7)
=1.7)
【答案】3d84s2 5 A 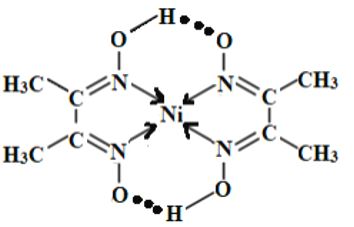 6 离子所带电荷数越高,离子半径越小,则晶格能越大,熔点越高 5 3 6 0.18
6 离子所带电荷数越高,离子半径越小,则晶格能越大,熔点越高 5 3 6 0.18
【解析】
(1)依据Ni的最外层电子排布式作答;
(2)A. CO与N2互为等电子体,互为等电子体的两种物质结构相似;
B. 依据价层电子对互斥理论和杂化轨道理论作答;
C. 找出[Ni(CN)4]2-和[Ni(NH3)6]2+两种配合物的配体个数;
D. 依据杂化轨道理论分析其杂化类型;
(3)依据配位键与氢键的存在原子种类分析;
(4)NiO的晶体结构类型与氯化钠相同;从离子晶体的晶格能角度分析熔点高低;
(5)①利用均摊法求出晶胞中La与Ni的原子个数比,进而得出化学式;
②根据空间构型分析作答;
③结合几何关系,找出六方晶胞的体积,再依据密度公式作答。
(1)Ni为28号元素,价电子排布式为3d84s2,排布时能量最高的电子所占的能级为3d,3d轨道有5个伸展方向,故答案为:3d84s2;5;
(2)A. CO、CN-与N2互为等电子体,N2分子内含1个σ键和2个π键,A项正确;
B. NH3中N原子为sp3杂化方式,VSEPR模型为四面体形,空间构型为三角锥形,B项错误;
C. [Ni(CN)4]2-和[Ni(NH3)6]2+中的Ni的化合价为+2价,其配位数分别是4和6,C项错误;
D. [Ni(CN)4]2-为正四面体,采用sp3杂化,而[Ni(NH3)6]2+是正方形,不是sp3杂化方式,D项错误;
故答案选A;
(3)中心原子提供空轨道,配体提供孤电子对形成配位键;氢键存在于已经与N、O和F等电负性很强的原子形成的共价键的H与另外的N、O和F等电负性很大的原子之间,则可以为: ;
;
(4)氯化钠中钠离子和氯离子的配位数分别是6,NiO的晶体结构类型与氯化钠相同,NiO晶胞中Ni和O的配位数分别6,影响离子晶体熔点的因素有离子半径和电荷,所带电荷数越高,离子半径越小,则晶格能越大,熔点越高;
(5)①该晶体的晶胞不是六棱柱,而是实线部分表示的平行六面体,各原子在晶胞中的位置可参照图a和b,如果将平行六面体抽取出来,晶胞如下图所示,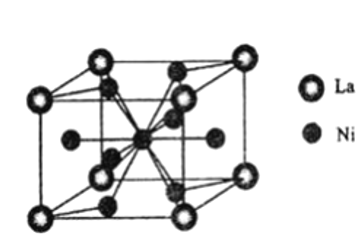 ,La在顶点,Ni在面心有4个(其中顶层和底层各2个,均摊后各1个,前后左右4个面各1个,均摊后共2个)和体心(1个),所以晶体化学式为LaNi5,x=5,
,La在顶点,Ni在面心有4个(其中顶层和底层各2个,均摊后各1个,前后左右4个面各1个,均摊后共2个)和体心(1个),所以晶体化学式为LaNi5,x=5,
②其正八面体空隙和四面体型空隙的位置如下图所示:
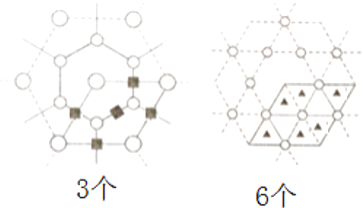 ,(若以空心球表示原子,实心球表示空隙的中心,则正八面体结构为
,(若以空心球表示原子,实心球表示空隙的中心,则正八面体结构为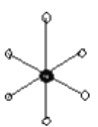 ,四面体结构为:
,四面体结构为: ;
;
③六方晶胞体积V=a2csinθ=(500×10-10)2×400×10-10×sin60°=8.5×10-23 cm3,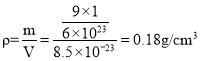 。
。


科目:高中化学 来源: 题型:
【题目】E是合成某药物的中间体,其一种合成路线如图:

(1)A中含氧官能团的名称是___。
(2)A→B的反应条件和试剂是___。
(3)D→E的反应类型是___。
(4)写出B→C的化学方程式___。
(5)E的分子式为___。
(6)B的环上二溴代物有___种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是一种天然抗氧化剂,具有较强的抗氧化活性,能有效降低癌症和动脉硬化的风险。其结构简式为:
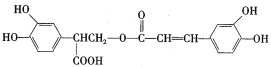
合成路线如下:
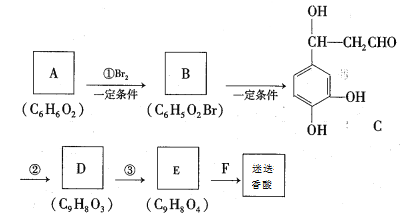
根据题意回答下列问题:
(1)A的结构简式为____________。
(2)①、②的反应类型分别是_____________、_____________。
(3)E的结构简式为__________________
(4)F在一定条件下发生缩聚反应的化学方程式为__________________________________
(5)写出一种与C互为同分异构体,且同时满足下列条件的有机的结构简式________________
①苯环上的一氯代物有2种
②1 mol该有机物能与1 molNaHCO3反应
③能与浓溴水反应,1 mol该有机物消耗3 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将6体积的NO2(不考虑N2O4)和一定体积的NO置于试管中,并将试管倒置于水中,当通入4.5体积的O2充分反应后,剩余1.5体积气体,则原NO体积可能为( )
①3体积 ②4体积 ③5体积 ④5.5体积 ⑤2体积
A.③B.⑤C.④或⑤D.②或⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,盛有PbO2的圆底烧瓶中滴加浓盐酸,产生黄绿色气体,其反应的化学方程式为_______。
(2)以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
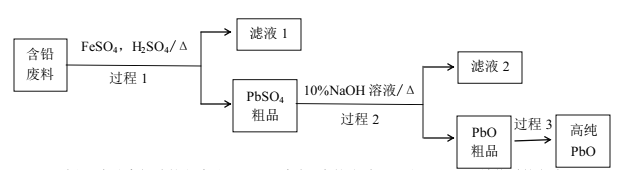
过程1中分离提纯的方法是___,滤液2中的溶质主要是____填物质的名称)。过程1中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是_______。
(3)将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
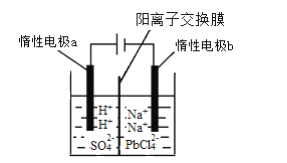
①写出电解时阴极的电极反应式_________。
②电解过程中通过阳离子交换膜的离子主要为____。
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向____极室(填“阴”或者“阳”)加入____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(7分)实验室用加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为: 。
所制得气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出适当选择,并将编号字母填入表中的空格处。
(1)装置:

(2)试剂: a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液
e.碱石灰 f.品红溶液 g.湿润的红色石蕊试纸
制取气体 | 杂质气体 | 制取气体的发生装置 | 除去杂质气体的净化装置 | 收集装置 | 净化装置内 所用试剂 | 检验制得气体所用试剂 |
NH3 | H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,在3支相同体积的试管中分别充有等体积混合的两种气体,它们是①NO和NO2,②NO2和O2,③NO和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3B.V1>V3>V2
C.V2>V3>V1D.V3>V1>V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,醋酸溶液中存在下述关系:![]()
(1)当向该溶液中加入一定量盐酸时,上式中的数值是否发生变化_________ ?为什么_________?
(2)若醋酸的起始浓度为0.010 mol L-1,平衡时c(H+)是多少_________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨水的叙述正确的是( )
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1mol·L-1的氨水指在1L溶液中含NH3、NH3·H2O、NH4+物质的量之和为1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com