
����Ŀ����7�֣�ʵ�����ü��ȹ����Ȼ�狀��������ƵĻ������ȡ������Ӧ�Ļ�ѧ����ʽΪ�� ��
���Ƶ������г����������������壬Ϊ�˵õ������İ��������Լ��飬��������װ�û��Լ��У�����Ҫ�������ʵ�ѡ���������ĸ������еĿո�
��1��װ�ã�

��2���Լ��� a��NaOH��Һ b������ʯ��ˮ c��Ũ���� d������NaHCO3��Һ
e����ʯ�� f��Ʒ����Һ g��ʪ��ĺ�ɫʯ����ֽ
��ȡ���� | �������� | ��ȡ����ķ���װ�� | ��ȥ��������ľ���װ�� | �ռ�װ�� | ����װ���� �����Լ� | �����Ƶ����������Լ� |
NH3 | H2O(g) |
���𰸡�Ca(OH)2 + 2NH4Cl ![]() CaCl2 + 2NH3��+ 2H2O��2���� �����¸���1����
CaCl2 + 2NH3��+ 2H2O��2���� �����¸���1����
NH3 | H2O��g�� | A | G | F | e | g |
��������ʵ������ȡ�����ķ���ʽΪCa(OH)2 + 2NH4Cl ![]() CaCl2 + 2NH3��+ 2H2O��
CaCl2 + 2NH3��+ 2H2O��
������ȡ������ԭ����֪������װ�����ڹ������֮�������ȡ����ģ�����ѡ��A�������Ǽ������壬����Ӧ���ü�ʯ�ң���ʯ�ҿ��Է��ڸ�����ڣ�����G��e��������������ˮ����������ˮ���ռ����������ܶ�С�ڿ����ģ��������ſ������ռ��������Ǽ������壬����ˮ�Լ��ԣ�������ʪ��ĺ�ɫʯ����ֽ���顣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ѧԺ������ѧ�����о��������״���ȡ��̼ϩ��(![]() ��������ù��ҿ�ѧ��������һ�Ƚ����ü�������ú�����ƺϳ������ɺϳ����Ƽ״��Ͱ���������ɼ״�����ϩ�ͱ�ϩ��
��������ù��ҿ�ѧ��������һ�Ƚ����ü�������ú�����ƺϳ������ɺϳ����Ƽ״��Ͱ���������ɼ״�����ϩ�ͱ�ϩ��
(1)ú��������һϵ�л�ѧ��Ӧ����֪�Ȼ�ѧ����ʽ��
![]()
![]()
![]()
![]()
��Ӧ![]()
![]() _____
_____![]()
(2)��Ͷ�ϱ�![]() �ϳɼ״���
�ϳɼ״���![]() ���¶ȡ�ѹǿ��
���¶ȡ�ѹǿ��![]() ��ƽ��ת���ʵĹ�ϵ��ͼ��ʾ
��ƽ��ת���ʵĹ�ϵ��ͼ��ʾ

�ش��������⣺
��![]() _____(���������)0
_____(���������)0
��![]() ______(����������������)
______(����������������)![]()
��![]() ��
��![]() ʱ��
ʱ��![]() ���
���![]() _____(��>����<��)
_____(��>����<��)![]() ��
��
������ʼʱ���Ͷ�ϱ�![]() ��ƽ��ת���ʽ�_______(����������������С��)��
��ƽ��ת���ʽ�_______(����������������С��)��
�ݲ����±���ʵ�ʹ�ҵ�����д�����![]() ��
��![]() �����ŵ���____________��
�����ŵ���____________��
span>���� | ���� | ���� | ��ע | �ص� | |
ѹ�� | �¶� | ||||
��ѹ�� |
��Ԫ���� | 25~30 | 380~400 | 1924�깤ҵ�� | (1)���������ж����������� (2)����Ӧ�� |
��ѹ�� |
��Ԫ���� | 5 | 230~270 | 1966�깤ҵ�� | (1)�������ж����������ף�����Ϊ1~2�� (2)����Ӧ�� |
(3)![]() ��
��![]() ����
����![]() �ķ�ӦΪ
�ķ�ӦΪ![]()
![]() ����
����![]() ���������µķ�Ӧ��������(
���������µķ�Ӧ��������(![]() ��ʾ����̬)
��ʾ����̬)
��ѧ������![]() ��
��![]()
���淴Ӧ![]() ��
��![]() ��
��![]()
�Ѹ���![]()
���У�![]() �������ֽⷴӦ��ܸߣ��������������˺ϳɰ������巴Ӧ����.
�������ֽⷴӦ��ܸߣ��������������˺ϳɰ������巴Ӧ����.
����������ߺϳɰ�ƽ����ʵ�������______(����ĸ)
A ���� B ���� C ��ѹ D ��ѹ E ����
�ڱ�ƽ�ⳣ��![]() ��
��![]() ������
������![]() Ϊ��ѹǿ(
Ϊ��ѹǿ(![]() )��
)��![]() ��
��![]() ��
��![]() Ϊ����ֵ�ƽ���ѹ����
Ϊ����ֵ�ƽ���ѹ����![]() ��
��![]() Ϊƽ����ѹ��
Ϊƽ����ѹ��![]() Ϊƽ��ϵͳ��
Ϊƽ��ϵͳ��![]() �����ʵ�������.��֪��ʼʱ��һ�ܱ�������Ͷ��
�����ʵ�������.��֪��ʼʱ��һ�ܱ�������Ͷ��![]()
![]() ��
��![]()
![]() ����Ӧ
����Ӧ![]()
![]() ��
��![]()
![]()
![]()
![]() �ں㶨�¶Ⱥͱ�ѹǿ�½��У�
�ں㶨�¶Ⱥͱ�ѹǿ�½��У�![]() ��ƽ�����Ϊ
��ƽ�����Ϊ![]() ����÷�Ӧ��
����÷�Ӧ��![]() ��________(�ú�
��________(�ú�![]() �Ĵ���ʽ��ʾ)����ͼ�п��Ա�ʾ��ƽ�ⳣ�����¶�
�Ĵ���ʽ��ʾ)����ͼ�п��Ա�ʾ��ƽ�ⳣ�����¶�![]() �ı仯���Ƶ���____________(����ĸ)
�ı仯���Ƶ���____________(����ĸ)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaNO2)��һ�ֳ��õ�ʳƷ���Ӽ���ʹ��ʱ���ϸ����������ʵ������2NO+Na2O2=2NaNO2Ϊԭ������������װ����ȡNaNO2(�гֺͼ���������)��

��֪��������KMnO4��Һ�ɽ�NO��NO2-����ΪNO3-��MnO4-����ԭΪMn2+��
��HNO2���в��ȶ��ԣ�2HNO2=NO2��+NO��+H2O��
�ش��������⣺
(1)�������������������ӿ�______________(��ӿ���ĸ)��
(2)ʵ�������Cװ���ڹ۲쵽��������___________________________��
(3)Na2O2��ַ�Ӧ�ⶨNaNO2��������ȡ��Ӧ��B�й�����Ʒ3.45g��������ˮ����ȴ����0.50mol�� L-1����KMnO4��Һ�ζ����ظ����Σ���Һƽ������Ϊ20.00mL��
�ٸòⶨʵ����Ҫ�õ����������е�___________(�����)��
a����ƿ b������ƿ c����ͷ�ι� d����ʽ�ζ��� e����ʽ�ζ��� f��������
�ڼٶ��������ʲ���KMnO4��Ӧ���������Ʒ��NaNO2�Ĵ���Ϊ____����
��ʵ��õ�NaNO2�ĺ�������ƫ�ͣ�������Ʒ�к��е���Ҫ����Ϊ_____(�ѧʽ)��Ϊ��߲�Ʒ��������ʵ��װ�õĸĽ�����Bװ��֮ǰ��װʢ��_____(��ҩƷ����)��______(����������)��
(4)���һ��ʵ�鷽��֤������������NaNO2����������________________________��
(�ṩ���Լ���0.10mol��L-1NaNO2��Һ��KMnO4��Һ��0.10mol��L-1KI��Һ��������Һ��ϡ���ᡢϡ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ����������
����������![]() ��Һ��ȫ��Ӧ���ټ���
��Һ��ȫ��Ӧ���ټ���![]() ��Һ����������������ѧ��Ӧ��
��Һ����������������ѧ��Ӧ��![]()
![]() �������й�˵���������
�������й�˵���������![]() ����
����![]()
A. ������![]()
B. ![]() �ܽ�
�ܽ�![]() ������
������![]()
C. ÿ��![]() �μӷ�Ӧ��ת�Ƶ��ӵ���ĿΪ
�μӷ�Ӧ��ת�Ƶ��ӵ���ĿΪ![]()
D. ��![]() L
L![]() ��״��
��״��![]() �μӷ�Ӧ������������
�μӷ�Ӧ������������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�����仯��������Ҫ�ĺϽ���Ϻʹ�������ش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ_____���Ų�ʱ������ߵĵ�����ռ�ܼ���ԭ�ӹ����____����չ����
��2�������γɶ�������������������ε�Ni(CO)4 �������ε�[Ni(CN)4]2-�����������ε�[Ni(NH3)6]2+�ȡ�����˵����ȷ����___
A��CO��CN-��Ϊ�ȵ����壬����CO��������������������֮��Ϊ1:2-
B��NH3�Ŀռ乹��Ϊƽ��������
C��Ni2+���γ������ʱ������λ��ֻ��Ϊ4
D��Ni(CO)4��[Ni(CN)4]2-�У���Ԫ�ؾ���sp3�ӻ�
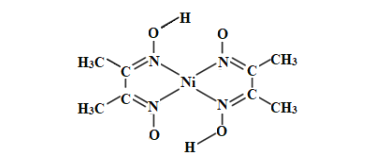
��3������ͪ뿳����ڼ���Ni2+����ϡ��ˮ�У�����ͪ���Ni2+��Ӧ�����ʺ�ɫ��������ṹ��ͼ��ʾ���ýṹ�У������ۼ��������λ�������������ͼ�����������������ֱ��ʾ����λ���������_____
��4��NiO�ľ���ṹ�������Ȼ��Ƶ���ͬ��������Ӱ뾶���±���
![]()
NiO������Ni2+����λ��Ϊ____��NiO�۵��NaCl�ߵ�ԭ����_____��
��5���о����������Ͻ�LaNix��һ�����õĴ�����ϡ���������ϵ,�侧����ͼa��ʵ����ʾ������λ�������֣��ֱ��ǰ������϶����![]() �������������϶����
�������������϶����![]() ��������ͼb��c����Щ������ԭ�Ӵ洢��������ʱ�����仯ѧʽΪLaNixHy��
��������ͼb��c����Щ������ԭ�Ӵ洢��������ʱ�����仯ѧʽΪLaNixHy��
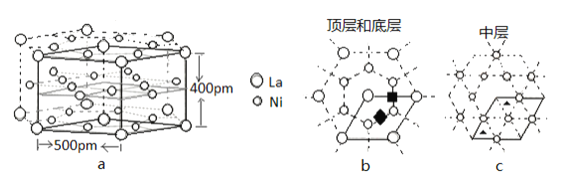
��LaNix�Ͻ���x��ֵΪ_____��
�ھ����к���![]() ��ͬ��İ������϶��___��������
��ͬ��İ������϶��___��������![]() ��ͬ����������϶��___����
��ͬ����������϶��___����
����H���뾧��������������䣬H������ܶ���______g/cm-3������2λ��Ч���֣�NA=6.0��1023��![]() =1.7��
=1.7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ�Ļ������ף����ܺ�NO��CO2��NO2��N2�еļ��֣���һ�����ļ����徭����ͼʵ��Ĵ���������õ�������Һ��������������ʣ�࣬�����������Ϊ�� ��

A.NO2��N2B.NO��CO2
C.NO2��CO2D.NO��CO2��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�������ˮ�ⷴӦ��Ӧ��˵����ȷ����(����)
A.����FeCl3����ֱ������ˮ��FeCl3��Һ
B.�ȵĴ�����Һȥ����Ч����
C.Al(NO3)3��Һ��K2S��Һ��Ϻ�����������
D.Mg��Ͷ�뵽����NH4Cl��Һ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ���ܴ���������ǣ� ��
A. ʹpH��ֽ����ɫ����Һ�У�Na����Mg2����ClO����HSO3-
B. c(Fe3��)��0.1 mol��L��1����Һ�У�K����NH4+��SO42-��SCN��
C. ![]() ��0.1 mol��L��1����Һ�У�Na����HCO3-��K����NO3-
��0.1 mol��L��1����Һ�У�Na����HCO3-��K����NO3-
D. 0.1 mol��L��1��NaHCO3��Һ�У�NH4+��NO3-��Na����SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��A��E���ֺ��������ת���Ĺ�ϵͼ������A��B��C��D�����¶������壬��BΪ����ɫ���塣

��1��д���������ʵĻ�ѧʽ��
A___��B___��C___��D____��E___��
��2��д�����������Ӧ�Ļ�ѧ����ʽ��
��___����___����___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com