
【题目】如图是A→E五种含氮物质相互转化的关系图。其中A、B、C、D常温下都是气体,且B为红棕色气体。

(1)写出下列物质的化学式:
A___、B___、C___、D____、E___。
(2)写出下面各步反应的化学方程式:
①___、②___、⑤___。
【答案】N2 NO2 NO NH3 HNO3 N2+O2![]() 2NO 4NH3+5O2
2NO 4NH3+5O2![]() 4NO+6H2O 3NO2+H2O=2HNO3+NO
4NO+6H2O 3NO2+H2O=2HNO3+NO
【解析】
根据题给信息,由B为红棕色气体可分析得出B为NO2,根据及题给的物质状态信息及A→E为五种含氮物质,结合图中A、B、C、D、E之间的转化关系可知,A为N2,B为NO2,C为NO,D为NH3,E为HNO3。据此进行分析。
(1)由分析可知:A为N2,B为NO2,C为NO,D为NH3,E为HNO3。故答案为:N2;NO2;NO;NH3;HNO3;
(2)反应中涉及的反应方程式为:①N2+O2![]() 2NO;②4NH3+5O2
2NO;②4NH3+5O2![]() 4NO+6H2O;⑤3NO2+H2O=2HNO3+NO;答案为:N2+O2
4NO+6H2O;⑤3NO2+H2O=2HNO3+NO;答案为:N2+O2![]() 2NO;4NH3+5O2
2NO;4NH3+5O2![]() 4NO+6H2O;3NO2+H2O=2HNO3+NO;
4NO+6H2O;3NO2+H2O=2HNO3+NO;


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】(7分)实验室用加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为: 。
所制得气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出适当选择,并将编号字母填入表中的空格处。
(1)装置:

(2)试剂: a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液
e.碱石灰 f.品红溶液 g.湿润的红色石蕊试纸
制取气体 | 杂质气体 | 制取气体的发生装置 | 除去杂质气体的净化装置 | 收集装置 | 净化装置内 所用试剂 | 检验制得气体所用试剂 |
NH3 | H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3溶液中存在CO32-+H2O![]() HCO3-+OH-平衡。下列说法不正确的是
HCO3-+OH-平衡。下列说法不正确的是
A.稀释溶液,[c(HCO3-)·c(OH-)]/c(CO32-)增大
B.通入CO2,溶液pH减小
C.升高温度,平衡常数增大
D.加入NaOH固体,c(HCO3-)/c(CO32-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,CO和水蒸气分别为1 mol、3 mol,在密闭容器中发生反应CO+H2O(g)![]() CO2+H2,达平衡后测得CO2为0.75 mol,再通入6 mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和可能为
CO2+H2,达平衡后测得CO2为0.75 mol,再通入6 mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和可能为
A. 1.2 mol B. 1.8 mol C. 2.5 mol D. 1.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨水的叙述正确的是( )
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1mol·L-1的氨水指在1L溶液中含NH3、NH3·H2O、NH4+物质的量之和为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:①NaHSO4晶体,②液态O2 ,③冰醋酸(固态醋酸), ④汞,⑤BaSO4固体,⑥Fe(OH)3 胶体,⑦酒精(C2H5OH) ,⑧熔化KNO3,⑨盐酸,⑩金属钠,请回答下列问题(用序号):
(1)以上物质中能导电的是__________
(2)以上物质属于电解质的是_____________
(3)以上物质中属于非电解质的是_______
(4)请写出①在熔融状态下的电离方程式________________
(5)a. 写出制备⑥的实验操作为_________;
b. 制备⑥的离子方程式为____________________,
c. 在制得的⑥中逐滴加入稀硫酸的实验现象为_____________________________。
(6)写出⑩在加热条件下与氧气反应的化学方程式________________________。若将2.3克钠放入97.7克水中,生成的溶液中溶质的质量分数_________(填“大于”、“小于” 或“等于”)2.3%。
(7)标准状况下,CO与CO2相对于②的密度为1,则混合气体中CO与CO2的比例为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B. [实验化学]
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:

已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
苯胺 | -6℃ | 184.4℃ | 3.4 |
醋酸 | 16.6℃ | 118℃ | 易溶 |
实验步骤如下:
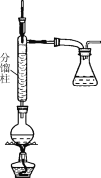
步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照如图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
(1)步骤1中加入锌粉的作用是________。
(2)步骤2中控制温度计示数约105℃的原因是________。
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是__________________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物可实现苯酚(![]() )废水的净化,装置如图所示。下列有关说法正确的是
)废水的净化,装置如图所示。下列有关说法正确的是
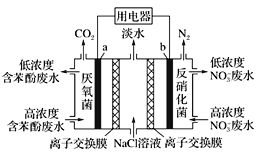
A. a极的电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
B. b极为正极,发生氧化反应
C. 中间室的Na+向左室移动
D. 右室生成0.1 mol N2时,用电器流过0.5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应:N2(g)+O2(g)![]() 2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)。
2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)。
A.缩小体积使压强增大______________________________________________________。
B.体积不变充入N2使压强增大________________________________________________。
C.体积不变充入氩气使压强增大_______________________________________________。
D.压强不变充入氩气使体积增大_______________________________________________。
E.增大体积使压强减小_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com