
【题目】已知25℃时,醋酸溶液中存在下述关系:![]()
(1)当向该溶液中加入一定量盐酸时,上式中的数值是否发生变化_________ ?为什么_________?
(2)若醋酸的起始浓度为0.010 mol L-1,平衡时c(H+)是多少_________?
【答案】不变 电离常数不随浓度的变化而变化,在一定温度下是一个常数 4.18×10-4 mol·L-1
【解析】
(1)根据电离常数只与温度有关系分析;
(2)根据电离平衡常数计算。
(1)由于电离常数不随浓度的变化而变化,在一定温度下是一个常数,因此当向该溶液中加入一定量盐酸时,虽然抑制了电离,但上式中的数值是不变的;
(2)忽略水的电离,根据醋酸的电离平衡CH3COOH![]() CH3COO-+H+可知溶液中氢离子的和醋酸根离子相等,由于醋酸的电离程度很小,因此溶液中醋酸分子的浓度约等于0.01mol/L,则带入电离平衡常数表达式可知溶液中氢离子浓度为
CH3COO-+H+可知溶液中氢离子的和醋酸根离子相等,由于醋酸的电离程度很小,因此溶液中醋酸分子的浓度约等于0.01mol/L,则带入电离平衡常数表达式可知溶液中氢离子浓度为![]() 4.18×10-4 mol·L-1。
4.18×10-4 mol·L-1。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】(1)现将200mL0.30mol/L的盐酸与50mL0.80mol/LCaCl2溶液混合(混合后体积变化忽略不计),所得溶液中Cl-的物质的量浓度是___。
(2)将20.0g氢氧化钠固体溶于水配成100mL溶液,其密度为1.25g·mL-1。该溶液中氢氧化钠的物质的量浓度为___,质量分数为___,从该溶液中取出10 mL,将其加水稀释到100 mL,稀释后溶液中氢氧化钠的物质的量浓度为___,将一定体积的原溶液和稀释后的溶液按1:4的体积比混合(忽略混合时溶液体积变化),所得混合溶液中氢氧化钠的物质的量浓度为___。
(3)气体化合物A分子式可表示为OxFy,已知同温同压下10mLA受热分解生成15mLO2和10mLF2,则A的化学式为___,推断的依据为___;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为_____,排布时能量最高的电子所占能级的原子轨道有____个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2-
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数只能为4
D.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化
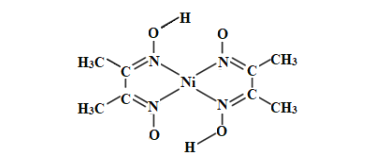
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“”分别表示出配位键和氢键。_____
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
![]()
NiO晶胞中Ni2+的配位数为____,NiO熔点比NaCl高的原因是_____。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。属六方晶系,其晶胞如图a中实线所示,储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
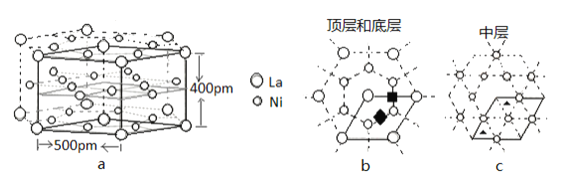
①LaNix合金中x的值为_____;
②晶胞中和“![]() ”同类的八面体空隙有___个,和“
”同类的八面体空隙有___个,和“![]() ”同类的四面体空隙有___个。
”同类的四面体空隙有___个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______g/cm-3(保留2位有效数字,NA=6.0×1023,![]() =1.7)
=1.7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐类水解反应的应用说法正确的是( )
A.可以把FeCl3固体直接溶于水制FeCl3溶液
B.热的纯碱溶液去油污效果好
C.Al(NO3)3溶液与K2S溶液混合后无明显现象
D.Mg粉投入到饱和NH4Cl溶液中无明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是________(填“强电解质”或“弱电解质”,下同),BOH是_______。
(2)HA的电离方程式是____________________________________。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/c(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体________(填“多”、“少”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 使pH试纸显蓝色的溶液中:Na+、Mg2+、ClO-、HSO3-
B. c(Fe3+)=0.1 mol·L-1的溶液中:K+、NH4+、SO42-、SCN-
C. ![]() =0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
=0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
D. 0.1 mol·L-1的NaHCO3溶液中:NH4+、NO3-、Na+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A+3B![]() 2C+2D在4种不同条件下的反应速率(单位为mol·L-1·s-1)分别为①v(A)=0.15 ②v(B)=0.6 ③v(C)=0.4 ④v(D)=0.45该反应反应速率最快的条件是( )
2C+2D在4种不同条件下的反应速率(单位为mol·L-1·s-1)分别为①v(A)=0.15 ②v(B)=0.6 ③v(C)=0.4 ④v(D)=0.45该反应反应速率最快的条件是( )
A. ② B. ④ C. ①和④ D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)已知:I2+2S2O===S4O+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入 ,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是 (用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用 作滴定指示剂,滴定终点的现象是 。
②CuCl2溶液与KI反应的离子方程式为 。
③该试样中CuCl2·2H2O的质量百分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 0.1 mol NaHSO4固体中含有的离子总数为0.3NA
B. 1L 1 mo1·L-1的(NH4)2CO3溶液中所含NH4+的数目为2NA
C. 标况下,22.4L Cl2通入水中,转移的电子数为NA
D. 20g D2O含有的中子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com