
【题目】25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是________(填“强电解质”或“弱电解质”,下同),BOH是_______。
(2)HA的电离方程式是____________________________________。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/c(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体________(填“多”、“少”或“相等”)。
【答案】弱电解质; 强电解质 HAH++A- B 多
【解析】
(1)首先判断出溶液中氢离子或氢氧根离子浓度,然后结合酸碱的浓度判断电解质强弱;
(2)HA为弱电解质,在溶液中部分电离,存在电离平衡;
(3)根据稀释促进电离分析解答;
(4)等pH时,弱电解质的物质的量浓度大于盐酸的浓度,据此解答。
(1)25℃时,0.1molL-1的某酸HA中,如果该酸是强酸,氢离子浓度为0.1mol/L,氢氧根离子浓度为:10-13mol/L,则c(H+)/c(OH-)=1012>1010,所以该酸是弱酸;0.01molL-1的BOH溶液pH=12,溶液中氢氧根离子的浓度为0.01mol/L,说明BOH完全电离,属于强电解质;
(2)弱酸在水溶液里存在电离平衡,其电离方程式为HA![]() H++A-;
H++A-;
(3)A.加水稀释促进了弱酸的电离,溶液中氢离子的物质的量增大,HA的物质的量减小,相同溶液中:n(H+)/n(HA)=c(H+)/c(HA),所以其比值增大,故A错误;
B.加水稀释促进酸电离,酸浓度、酸根离子浓度都降低,但酸根离子浓度减小的量小于酸分子减小的量,所以c(HA)/c(A-)减小,故B正确;
C.c(H+)与c(OH-)的乘积为水的离子积,温度不变,水的离子积常数不变,故C错误;
D.加水稀释促进酸电离,氢离子浓度降低,但氢氧根离子浓度增大,故D错误;
故答案选B;
(4)等pH的HA溶液和盐酸,HA是弱酸,盐酸是强酸,所以HA的物质的量浓度大于盐酸,等体积等pH的HA和盐酸,HA的物质的量大于盐酸,所以向等体积、等pH的HA溶液和盐酸中分别加入足量Zn,产生的H2是HA多。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】理解和应用信息在有机合成中具有重要作用,请依据下列信息回答问题:
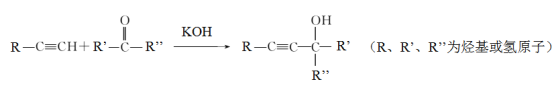
(1)该反应类型为_______________
(2)下列物质能发生上述反应的是______
A.![]() 与
与![]()
B.![]() 与HCHO
与HCHO
C.![]() 与
与![]()
(3)![]() 和
和![]() 在上述条件下能够合成分子式为C8H14O2的物质,该物质的结构简式为________________
在上述条件下能够合成分子式为C8H14O2的物质,该物质的结构简式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,盛有PbO2的圆底烧瓶中滴加浓盐酸,产生黄绿色气体,其反应的化学方程式为_______。
(2)以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
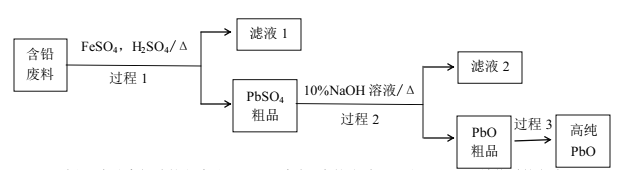
过程1中分离提纯的方法是___,滤液2中的溶质主要是____填物质的名称)。过程1中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是_______。
(3)将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
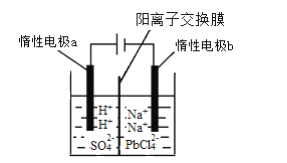
①写出电解时阴极的电极反应式_________。
②电解过程中通过阳离子交换膜的离子主要为____。
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向____极室(填“阴”或者“阳”)加入____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,在3支相同体积的试管中分别充有等体积混合的两种气体,它们是①NO和NO2,②NO2和O2,③NO和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3B.V1>V3>V2
C.V2>V3>V1D.V3>V1>V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸式盐NaHY的水溶液c(OH-)>c(H+),下列叙述正确的是
A. H2Y的电离方程式:H2Y![]() 2H++Y2-
2H++Y2-
B. HY-的水解方程式:HY-+ H2O![]() H3O++ Y2-
H3O++ Y2-
C. 该酸式盐溶液中离子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H+)
D. 该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,醋酸溶液中存在下述关系:![]()
(1)当向该溶液中加入一定量盐酸时,上式中的数值是否发生变化_________ ?为什么_________?
(2)若醋酸的起始浓度为0.010 mol L-1,平衡时c(H+)是多少_________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了有效实现NO和NO2的相互转化,设计如下实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。
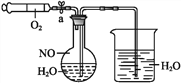
(1)打开止水夹,推动针筒活塞,使O2进入圆底烧瓶。关闭止水夹,首先观察到圆底烧瓶中的现象为_________,产生此现象的化学反应方程式为__。
(2)轻轻摇动圆底烧瓶,观察到圆底烧瓶中的现象为①___________;②________。产生此现象的化学反应方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成药物查尔酮类抑制剂的中间体,可由X在一定条件下反应制得:

下列叙述正确的是( )
A. 反应过程中加入K2CO3,能提高X的转化率
B. Y与Br2的加成产物分子中不含手性碳原子
C. X和Y均能与新制的Cu(OH)2在加热条件下反应生成砖红色沉淀
D. 等物质的量的X、Y分别与H2反应,最多消耗H2的物质的量之比为3∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种高效除草剂,其合成路线流程图如下:
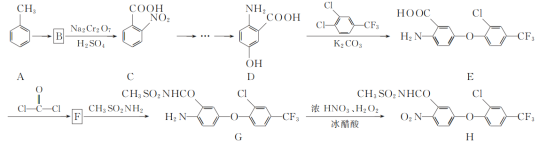
(1)E中含氧官能团名称为________和________。
(2)A→B的反应类型为________。
(3)写出同时满足下列条件的D的一种同分异构体的结构简式:________。
①不能发生水解反应,能与FeCl3溶液发生显色反应:
②分子中有4种不同化学环境的氢。
(4)F的分子式为C15H7ClF3NO4,写出F的结构简式:________。
(5)已知:—NH2与苯环相连时,易被氧化;—COOH与苯环相连时,再引入其他基团主要进入它的间位。请写出以A和D为原料制备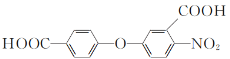 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com