
【题目】Y是合成药物查尔酮类抑制剂的中间体,可由X在一定条件下反应制得:

下列叙述正确的是( )
A. 反应过程中加入K2CO3,能提高X的转化率
B. Y与Br2的加成产物分子中不含手性碳原子
C. X和Y均能与新制的Cu(OH)2在加热条件下反应生成砖红色沉淀
D. 等物质的量的X、Y分别与H2反应,最多消耗H2的物质的量之比为3∶4
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是________(填“强电解质”或“弱电解质”,下同),BOH是_______。
(2)HA的电离方程式是____________________________________。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/c(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体________(填“多”、“少”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A+3B![]() 2C+2D在4种不同条件下的反应速率(单位为mol·L-1·s-1)分别为①v(A)=0.15 ②v(B)=0.6 ③v(C)=0.4 ④v(D)=0.45该反应反应速率最快的条件是( )
2C+2D在4种不同条件下的反应速率(单位为mol·L-1·s-1)分别为①v(A)=0.15 ②v(B)=0.6 ③v(C)=0.4 ④v(D)=0.45该反应反应速率最快的条件是( )
A. ② B. ④ C. ①和④ D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某4L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示。乙图为达到平衡后在t2、t3、t4、t5时改变某一种反应条件,平衡体系中速率随时间变化的情况,且所改变的条件均不同。已知t3-t4阶段为使用催化剂。则下列说法不正确的是
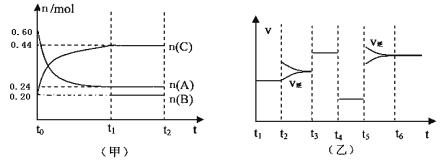
A.若t1=15s,则t0—t1阶段以A浓度变化表示的反应速率v(A)为0.006mol/(L·s)
B.B既不是反应物,也不是生成物,可能是反应的催化剂
C.若t2—t3阶段改变的条件是增大A的浓度,则平衡时C的体积分数变小。
D.该反应为放热反应,t5—t6阶段是升高反应体系的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)已知:I2+2S2O===S4O+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入 ,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是 (用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用 作滴定指示剂,滴定终点的现象是 。
②CuCl2溶液与KI反应的离子方程式为 。
③该试样中CuCl2·2H2O的质量百分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
Ⅰ.测定中和热.
写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__________________________
(中和热数值为57.3kJ/mol):
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______________(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为_________________。

(2)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(3)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
滴定终点的判断__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,A是单质,B的焰色反应呈黄色。判断A、B、C、D的化学式:

A_____ B______ C______ D______
下列转化的化学方程式为:
(1)A→B__________
(2)B→D________
(3)A→C__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2常用于催化剂。某化学小组在实验室选用下图所示装置 (夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。

已知:①在浓硫酸存在下,加热到140℃时乙醇脱水生成乙醚(C2H5OC2H5),加热到170℃时乙醇脱水生成CH2 = CH2。
②乙醚的熔点为34.6℃,沸点为132℃。
③Mg和Br2剧烈反应,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应 MgBr2 +3C2H5OC2H5 ![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
实验主要步骤如下:
I.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
II.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
III.通入干燥的氮气,让液溴缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤反应物,将得到的滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,减压过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水 MgBr2。
回答下列问题:
(1)装置A中使用仪器m的优点是________。
(2)步骤I中所选装置的正确连接顺序是a________ (填小写字母)。装置D的作用是________。
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是________。
(4)步骤V中用苯洗涤三乙醚合溴化镁的目的是________。
(5)步骤V采用减压过滤(使容器内压强降低,以达到固液快速分离)。下列装置可用作减压过滤的是________(填序号)。

(6)实验中若温度控制不当,装置B中会产生CH2Br—CH2Br。请设计实验验证 CH2Br—CH2Br的存在:从反应后的混合物中分离提纯得到CH2Br—CH2Br,_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com