
【题目】向某4L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示。乙图为达到平衡后在t2、t3、t4、t5时改变某一种反应条件,平衡体系中速率随时间变化的情况,且所改变的条件均不同。已知t3-t4阶段为使用催化剂。则下列说法不正确的是
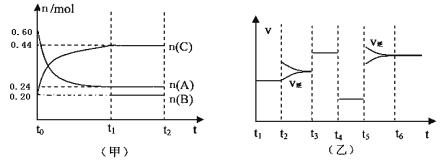
A.若t1=15s,则t0—t1阶段以A浓度变化表示的反应速率v(A)为0.006mol/(L·s)
B.B既不是反应物,也不是生成物,可能是反应的催化剂
C.若t2—t3阶段改变的条件是增大A的浓度,则平衡时C的体积分数变小。
D.该反应为放热反应,t5—t6阶段是升高反应体系的温度
【答案】C
【解析】
试题由图甲可知,t0—t1阶段A的物质的量降低,为反应物,C的物质的量增加为生成物,正反应是一个体积减小的反应; A、t0—t1阶段A的物质的量由0.60mol降为0.24mol,若t1=15s,则t0—t1阶段以A浓度变化表示的反应速率v(A)为(0.60mol-0.24mol)/4L/15s=0.006mol/(L·s) ,A正确;B、B既不是反应物,也不是生成物,可能是反应的催化剂,B正确;C、若t2—t3阶段改变的条件是增大A的浓度,则容器内的压强增大,平衡向体积减小的方向移动,平衡时C的体积分数变大,C错误;D、该反应为放热反应,t5—t6阶段是升高反应体系的温度,正、逆反应速率增大,平衡向逆反应方向移动,D正确;答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)氮氧化物是形成光化学烟雾和酸雨的一个重要原因,用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:![]() △H=-1160kJ·mol-1
△H=-1160kJ·mol-1
![]() △H=+293kJ·mol-1
△H=+293kJ·mol-1
则该条件下,CH4催化还原NO2消除污染的热化学方程式为________________________。
(2)乙炔(CH≡CH)是重要的化工原料。工业上可用甲烷裂解法制取乙炔:![]() 同时发生副反应:
同时发生副反应:![]() ;甲烷裂解时,几种气体平衡时分压(Pa)的对数即lgP与温度(℃)之间的关系如图所示。根据图判断,反应
;甲烷裂解时,几种气体平衡时分压(Pa)的对数即lgP与温度(℃)之间的关系如图所示。根据图判断,反应![]() △H___0(填“>”或“<”)。
△H___0(填“>”或“<”)。

1725℃时,向恒容密闭容器中充入CH4,达到平衡时CH4生成C2H2的平衡转化率为_____。该温度下,![]() 的平衡常数Kp=_______[注:用平衡分压(Pa)代替平衡浓度(mol·L-1)进行计算]。
的平衡常数Kp=_______[注:用平衡分压(Pa)代替平衡浓度(mol·L-1)进行计算]。

(3)利用在特定条件下用铂电极(阳极为铂丝)电解饱和硫酸氢钾溶液的方法制备K2S2O8(过二硫酸钾)。在低温下电解液中主要含有K+、H+和![]() 离子,电流通过溶液后发生反应。阳极区电极反应式为______________________________,X为_________交换膜(填“质子”、“阳离子”或“阴离子”),当电路中通过0.2mol e-时,两边溶液质量的变化差为_________。
离子,电流通过溶液后发生反应。阳极区电极反应式为______________________________,X为_________交换膜(填“质子”、“阳离子”或“阴离子”),当电路中通过0.2mol e-时,两边溶液质量的变化差为_________。
(4)甲烷燃料电池采用铂为电极,两电极上分别通入CH4和O2,电解质溶液为300mL 1.0mol·L-1的NaOH溶液。当O2通入量为8.96L(标准状况)且反应完全时,所得溶液中各离子浓度由大到小的顺序为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸式盐NaHY的水溶液c(OH-)>c(H+),下列叙述正确的是
A. H2Y的电离方程式:H2Y![]() 2H++Y2-
2H++Y2-
B. HY-的水解方程式:HY-+ H2O![]() H3O++ Y2-
H3O++ Y2-
C. 该酸式盐溶液中离子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H+)
D. 该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了有效实现NO和NO2的相互转化,设计如下实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。
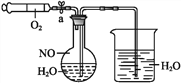
(1)打开止水夹,推动针筒活塞,使O2进入圆底烧瓶。关闭止水夹,首先观察到圆底烧瓶中的现象为_________,产生此现象的化学反应方程式为__。
(2)轻轻摇动圆底烧瓶,观察到圆底烧瓶中的现象为①___________;②________。产生此现象的化学反应方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )

A. 盐酸中逐滴加入氢氧化钠溶液
B. 硫酸铜溶液中逐滴加入氢氧化钡溶液
C. 硫酸中逐滴加入氯化钡溶液
D. 盐酸中逐滴加入硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成药物查尔酮类抑制剂的中间体,可由X在一定条件下反应制得:

下列叙述正确的是( )
A. 反应过程中加入K2CO3,能提高X的转化率
B. Y与Br2的加成产物分子中不含手性碳原子
C. X和Y均能与新制的Cu(OH)2在加热条件下反应生成砖红色沉淀
D. 等物质的量的X、Y分别与H2反应,最多消耗H2的物质的量之比为3∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为1 L的恒容密闭容器中按不同方式投入反应物,发生反应CO(g)+2H2(g)![]() CH3OH(g)(正反应放热),测得反应的相关数据如下:
CH3OH(g)(正反应放热),测得反应的相关数据如下:
容器 | 容器1 | 容器2 | 容器3 |
反应温度T/K | 500 | 500 | 600 |
反应物投入量 | 1 mol CO、 2 mol H2 | 2 mol CH3OH | 1 mol CO、 2 mol H2 |
平衡v正(H2)/(mol·L-1·s-1) | v1 | v2 | v3 |
平衡c(CH3OH)/(mol·L-1) | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的转化率α | α1(CO) | α2(CH3OH) | α3(CO) |
平衡常数K | K1 | K2 | K3 |
下列叙述正确的是( )
A. v1<v2,2c1>c2B. α1(CO)>α3(CO),v1<v3
C. p2>2p3,K1<K3D. c2>2c3,α2(CH3OH)+α3(CO)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。

(1)除如图装置所示的实验用品外,还需要的一件实验用品是______________。
(2)圆底烧瓶中所发生反应的离子方程式为___________。
(3)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(4)利用该化学反应,试简述测定反应速率的其他方法:________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2 Na2S2O3=== Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(5)表中Vx=__________mL,T1、T2、T3的大小关系是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是
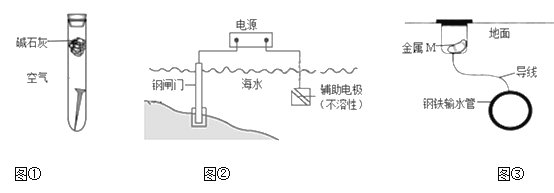
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
C. 图②,若断开电源,钢闸门将发生吸氧腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com